Zum Stellenwert der Korrosion bei metallhaltigem Zahnersatz
Wolf-Dieter Müller
Korrosion von metallischen zahnärztlichen Konstruktionen im Patientenmund ist zwar ein bekanntes, aber doch meist unterschätztes Phänomen. Anliegen dieses Beitrages ist es, die Grundlagen, Möglichkeiten der Bewertung und mögliche Folgen an Hand von Beispielen etwas näher zu beleuchten. Vier ausgewählte Beispiele dienen der Darstellung von unterschiedlichen Korrosionserscheinungen, die u.a. auf Gussfehler, die Kombination unterschiedlicher Legierungen und unsachgemäße Behandlung sowie die Bildung von galvanischen Elementen zurückzuführen sind. Schlussfolgernd daraus wäre es wünschenswert, wenn diesen Phänomenen mehr Beachtung geschenkt würde, um so mögliche gesundheitliche Schäden von den Patienten abzuwenden.
Korrosion tritt immer dann auf, wenn Wasser in Kontakt mit Metall kommt. Daher hat man mit den Folgen korrosiver Prozesse in vielen Bereichen unseres Lebensumfeldes zu tun, so auch in der Zahnmedizin und Zahntechnik. Dies wird unter dem Gesichtspunkt, dass es über 1.000 verschiedene Dentallegierungen auf dem Weltmarkt gibt, besonders wichtig, zudem auch noch Kombinationen verschiedener Legierungen eingesetzt werden, was heute noch als Stand der Technik akzeptiert wird. Anliegen dieses Beitrages ist es, Korrosion ein wenig näher zu beleuchten und zu bewerten.

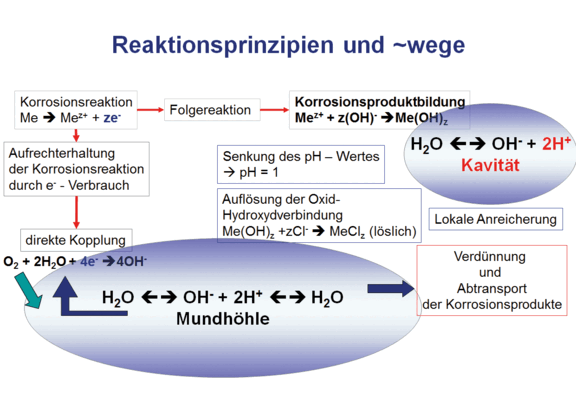
Korrosion ist eine elektrochemische Redoxreaktion, d.h. eine Verknüpfung einer Oxidations- mit einer Reduktionsreaktion, die nicht notwendigerweise an ein und demselben Ort ablaufen müssen. In der Abb. 1 sind diese formalen Zusammenhänge schematisch dargestellt. Die Trennung der Teilreaktionen, Oxidation und Reduktion, wird durch die elektrische Leitfähigkeit der Metalle/Legierungen möglich. So werden die in der Oxidationsreaktion frei werdenden Elektronen an einen Ort gelenkt, der zum Verbrauch der freigesetzten Elektronen entweder aus den im Wasser befindlichen Protonen Wasserstoff bildet, was an den Edelmetalloberflächen, insbesondere Platin (Pt), Gold (Au) und Palladium (Pd) möglich ist, oder an anderer Stelle durch die Reduktion von gelöstem Sauerstoff im Speichel mit der Bildung von Hydroxyd-Ionen. Diese Reaktion kann auch an Nichtedelmetalloberflächen ablaufen.
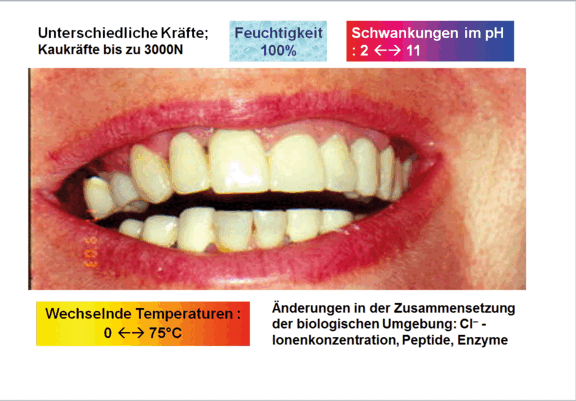
Die theoretischen Möglichkeiten sind recht einleuchtend, allerdings bereitet die objektive Bewertung der Korrosionsstabilität insbesondere von Dentallegierungen einige Probleme. Dentallegierungen sind Sonderlegierungen, da sie für den Einsatz in einem sehr speziellen „Testraum“, der Mundhöhle, entwickelt wurden und werden (Abb. 2).
Der Mundraum zeichnet sich dadurch aus, dass in einer permanent feuchten Umgebung wechselnde Kräfte wirken, wechselnde Temperaturen zwischen 0 und 75 °C erreicht werden können, der pH Wert zwischen 1 und 11 schwanken kann, aggressive Ionen, hier insbesondere die Chlorid-Ionen immer vorhanden sind sowie ein Cocktail unterschiedlicher Enzyme vorzufinden ist. Dies sind auch für Legierungen extreme Bedingungen, denen sie standhalten müssen. An dieser Stelle sei auch darauf hingewiesen, dass es sich bei den dentalen Konstruktionen um sehr grazile Bauteile handelt, wenn man die Kronenwandstärken, von bis zu 400 μm bzw. die Verbinderquerschnitte, von wenigen mm² betrachtet. Ein weiterer Aspekt, der in diese Betrachtungen mit einbezogen werden muss, sind Kombinationen mit anderen Werkstoffen, wie Keramiken und Kunststoffen, die verarbeitungsbedingt mechanische Spannungen und Defekte in der Grenzfläche hervorrufen.
Die Bewertung der Korrosionsfestigkeit von Dentallegierung wird entsprechend der ISO EN DIN 10271 vorgenommen (DIN 2011). Diese beschreibt die Durchführung, sowohl des Immersionstest’s in Kombination mit einer nasschemischen Analyse der Korrosionslösung, wie auch den Einsatz von elektrochemischen Messungen und den daraus bestimmbaren Grenzwerten.
Verschiedene Faktoren haben Einfluss auf den Ablauf und die Bewertung von Korrosionsprozessen, wie die Zeit, die Stellung der Elemente in der elektrochemischen Spannungsreihe, die chemische Stabilität von Oxydschichten sowie die Möglichkeit der Bildung löslicher Verbindungen.
Mit dem ersten Kontakt der Oberfläche des Metalls mit Wasser beginnt die Interaktion, die dazu führt, dass durch den Dipolcharakter der Wassermoleküle die Metalloberfläche polarisiert wird. Die Folge ist die Ausbildung einer elektrochemischen Doppelschicht, bei der sich ein Gleichgewicht zwischen an der Metalloberfläche adhärenten Metallionen und den von ihnen freigesetzten Elektronen (siehe Oxidationsreaktion) einstellt. Wird dieses Gleichgewicht in der Weise gestört, dass die Elektronen auf Grund der elektrischen Leitfähigkeit an eine andere Stelle der metallischen Konstruktion bewegt werden, an der eine der o.g. Reduktionsreaktionen ablaufen kann, müssen die Metallionen mit Anionen aus dem Wasser (OH-Ionen, oder wenn vorhanden auch Chlorid-Ionen) reagieren.
Die Reaktion mit OH--Ionen führt über die Stufe des Metallhydroxids zum Oxid. Ist letzteres chemisch unter den o.g. Bedingungen stabil, bildet sich eine Passivschicht, die das darunterliegende Metall vor weiterer Oxidation, was gleichbedeutend mit Korrosion ist, schützt.
Wird die schützende Oxidschicht jedoch mechanisch zerstört, wird diese Stelle durch die Bildung einer neuen Passivschicht repariert, allerdings können die abgetragenen Oxide nun durch einen sauren Aufschluss, z.B. im Magen, in wasserlösliche Metallionen überführt werden.
In Gegenwart von Chlorid-Ionen kommt es zu Konkurrenzreaktionen mit der Folge der Bildung von Metallhydroxiden und/oder von Metallchloriden. Letztere weisen in den meisten Fällen eine sehr gute Löslichkeit in wässrigen Elektrolyten auf.
Die an der Oberfläche der metallischen Konstruktion sich bildenden Chloride werden in Folge eines Verdünnungsprozesses von dieser Oberfläche abtransportiert und gelangen so in den Körper. Auf Grund ihrer Größe, Me-Ionen haben einen Durchmesser von 70–200 pm (Picometer = 0,001 Nanometer), sind sie in der Lage, durch Gewebeschichten und Zellmembranen hindurch zu diffundieren.
Ein weiteres Problem korrosiver Prozesse ist, dass sie in den meisten Fällen an Stellen ablaufen, die für eine direkte Beobachtung nicht zugänglich sind, wie z.B. Spalten und Lunker, so dass die Folgen erst dann sichtbar werden, wenn es zu spät ist.
An Hand von vier Beispielen sollen die Folgen der Korrosion beschrieben werden.
Durch Gussfehler bedingte Spaltkorrosion
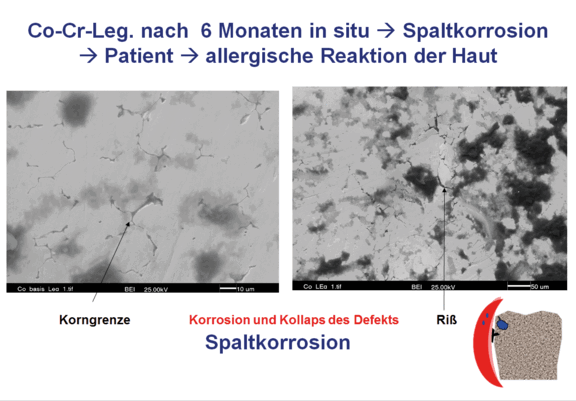
Die Rasterelektronenmikroskopischen Aufnahmen in Abb. 3 zeigen in der Kaufläche der Konstruktion aus einer Co-Cr-Legierung deutliche Gefügestrukturen sowie einen leichten Einbruch der Oberfläche. Darunter befindet sich ein Lunker, der in Folge des Einreißens der Deckstruktur mit Wasser gefüllt wurde. Dies entspricht einer klassischen Spaltkorrosionssituation, da die Außenfläche der Konstruktion immer mit frischem Speichel umspült wurde, stellte sich hier eine Verknüpfung zwischen der Oxidationsreaktion und der Reduktionsreaktion 2 ein. Schematisch ist der Reaktionsablauf und die Metallionenmigration in der Abb. 4 dargestellt.


Zunächst kommt es zur Bildung einer Oxydschicht im Inneren des Lunkers, die allerdings zur Folge hat, dass dadurch der pH Wert absinkt bis auf einen Wert von 1.
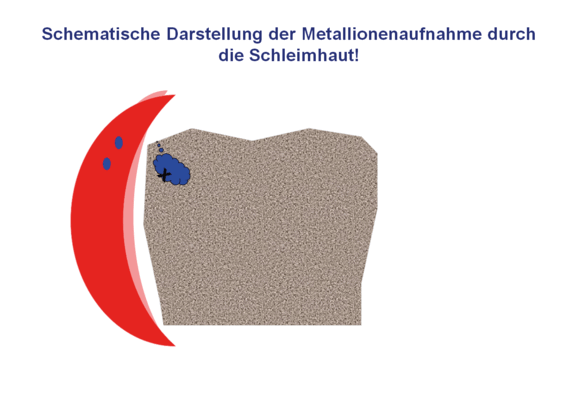
Dies wiederum führt dazu, dass die Oxydschichtstabilität abnimmt und die Passivschicht aufgelöst wird. Die Anreicherung von Salzen in dem Lunker führt zu einem chemischen Verdünnungsprozess, durch den Wasser aus der äußeren Umgebung in den Lunker diffundiert und gelöste Metallionen aus dem Lunker herausgeschwemmt werden. Durch den direkten Kontakt zur Schleimhaut kommt es dort zu einer lokalen Aufnahme mit der Folge der Rötung oder gar allergenen Reaktion auf die freigesetzten Metallionen, in diesem Fall Cobalt-Ionen.
Die Ursache war ein Gussfehler, der durch den Einsatz von CAD CAM gefrästen Strukturen minimiert, gar verhindert werden kann.
„Wasserstoffkorrosion“
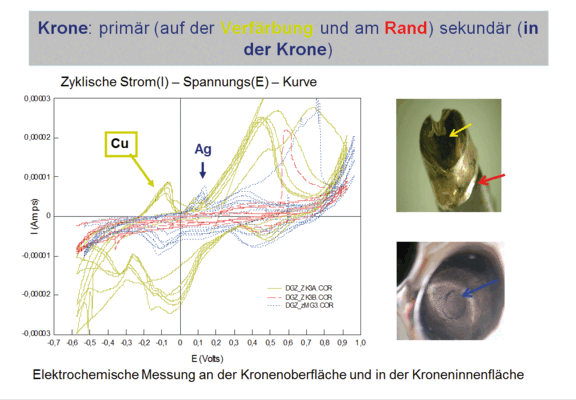
Häufig werden Edelmetalllegierungen mit Nichtedelmetalllegierungen in Modellgussprothesen (MOG) verbunden. An dem hier dargestellten Beispiel ist eine deutliche Verfärbung der Teleskopkronen (Edelmetalllegierung) zu beobachten, wohingegen der Bügel der Prothese aus einer Co-Cr-Legierung aussieht, als wäre er gerade poliert worden (siehe Abb. 5).
Ursache dafür ist u.a. die in Cl--Ionen haltigen Elektrolyten deutlich höhere Löslichkeit von Cu-Ionen aus Edelmetalllegierungen. Außerdem ist zu berücksichtigen, dass durch die thermischen Behandlungen, Gießen und Aufbrennen von Keramiken, die Cu-Atome durch das Metallgitter der Legierungen hindurch diffundieren und sich so an der Oberfläche anreichern, mit der Folge einer Veränderung der Legierungszusammensetzung. Unter dem Gesichtspunkt der Korrosionsstabilität muss noch ein weiterer Aspekt besonders berücksichtigt werden, nämlich der des Unterschiedes in den Atomgewichten zwischen Gold (Au) und Platin (Pt) auf der einen Seite und Kupfer (Cu) auf der anderen Seite. Letztere bringen nur 1/3 des Gewichtes der Au-Atome auf die Waage. Da elektrochemische Reaktionen über atomare Kontakte ablaufen, ist die Kenntnis der atomprozentigen Verhältnisse in den Edelmetalllegierungen sehr wichtig.
| Kin Palla A | Au | Ag | Pd | Cu | In |
|---|---|---|---|---|---|
| wt-% | 12% | 46% | 20% | 20% | 2% |
| at-/% | 6,05% | 42,35% | 18,6% | 31,3% | 1,7% |
Tab. 1: Gewichts(wt)-prozentige und Atom(at)-prozentige Zusammensetzung der Legierung KinPalla (GRUNDIG 2013).
Am Beispiel der Au-reduzierten Legierung KinPalla wird dies sehr deutlich, da demnach jedes dritte Atom ein Cu-Atom in der Legierung ist.
Derartige Veränderungen werden bei elektrochemischen Messungen deutlich sichtbar (siehe Abb. 6). Hierbei wurden auf einer Edelmetallteleskopkrone an unterschiedlichen Stellen Unterschiede im Verlauf der Strom(I) – Spannungs(E) – Kurven ermittelt. Diese weisen auf Veränderungen in der Zusammensetzung der Oberfläche hin. Mit Hilfe des Mini-Cell-Systems, einem Messsystem für elektrochemische Messungen zur Bewertung von metallischen Biomaterialien, wozu auch dentale Legierungen und daraus gefertigte Konstruktionen gehören, konnte gezeigt werden, dass es sich bei diesen Verfärbungen um Cu-Abscheidungen aus der Edelmetalllegierung handelt. Bedingt durch die mechanische Beanspruchung der Gleitflächen werden diese immer wieder aktiviert, so dass die Wasserstoffentwicklung an diesen Edelmetalloberflächen mit einer sehr geringen Verzögerung ablaufen kann.
An dieser Stelle sei angemerkt, dass jede Legierung einen für sie charakteristischen I-E-Kurvenverlauf zeigt. Neben den Hinweisen auf Veränderungen in der elektrochemischen Aktivität, insbesondere bedingt durch Veränderungen in der Oberflächenzusammensetzung, können aus den I-E-Kurven Aussagen zum Korrosionsverhalten und der Stabilität der Passivschicht abgeleitet werden (MÜLLER 2009). Beispielhaft soll dies an Messungen auf der Legierung KinPalla, deren Zusammensetzung in der Tab. 1 aufgeführt ist, demonstriert werden (siehe Abb. 7).
Zunächst zeigen sich an verschiedenen Messstellen (linker Teil der Abb. 7) unterschiedliche Kurvenverläufe. Alle Kurven weisen jedoch einen sogenannten Passivbereich aus. Letzterer verschwindet in allen Fällen (rechter Teil der Abb. 7), wie auch die vorher beobachteten Unterschiede nach einer Alterung, die auf elektrochemischem Wege simuliert wurde (GRUNDIG 2013).
Auch in diesem Beispiel handelt es sich um eine Modellgussprothese. Die in der Abb. 8 zu erkennende schwarze Verfärbung der Nichtedelmetallbasis ist auf eine zusätzliche Verstärkung der Korrosionsprozesse an der Nichtedelmetalloberfläche zurückzuführen.
Die Ursache liegt hier im unkontrollierten Einsatz von Prothesenreinigungsmitteln, die zur Reinigung der Prothese aktiven Sauerstoff freisetzen. Die Folgen sind fatal, wie die Mikroskopbilder zeigen. Es kommt zu dramatischen korrosiven Angriffen, wobei ganze Körner fast aus der Struktur durch Korngrenzenkorrosion herausgelöst wurden. Es laufen sowohl die Sauerstoffkorrosion an der NEM–Oberfläche als auch die Wasserstoffkorrosion an den EM–Oberflächen ab, was schematisch in der Abb. 8 im rechten Teil dargestellt ist.
Die in der Abb. 9 dargestellte Modellgussprothese wurde sowohl gelasert als auch gelötet. Die hier entstandene galvanische Kopplung zwischen einer hochgoldhaltigen Edelmetalllegierung und einer Co-Cr-Legierung ist die Ursache für das Versagen der Verbindung. Äußerlich war nicht viel zu erkennen. Erst nach dem Bruch der Verbindung wurde deutlich, dass die Grenzfläche, hier ein Lötkontakt, porös war und unschwer zu erkennen die Ursache für die Freisetzung von Metallionen war.
Wenn man nur einmal überschlägt, dass ca. 5 mm³ Metall aufgelöst wurden, heißt das, dass bei einer Dichte von ca. 8,5 g/cm³ ungefähr 42,5 mg herausgelöst wurden.



Da der Weg der Aufnahme durch den Körper nicht bekannt ist (siehe Abb. 10), und so auch keine Kontrolle existiert, sind letztlich allergene Reaktionen im Kontext mit anderen Ungleichgewichten im Körper nicht auszuschließen. Der sehr komplexe Ablauf von Korrosionsprozessen, wie in Abb. 11 noch einmal zusammengefasst, macht es nicht leicht, diese exakt vorher zu bestimmen. Besser ist es, mögliche Korrosion zu vermeiden, indem keine Legierungskombinationen mehr eingesetzt werden, Legierungen möglichst industriell vorgefertigt und nicht individuell gegossen werden, da dadurch dramatische Veränderungen in der Zusammensetzung auftreten können.
Die CAD CAM Technik bietet diese Möglichkeit, da die bei diesen Verfahren eingesetzten Metalllegierungen deutlich bessere Homogenität aufweisen.
Löten sollte als Fügetechnik nicht mehr genutzt werden, für den LASER Einsatz gilt, nur noch gleichartige Legierungen miteinander zu verbinden.
Vollständig verhindern kann man Korrosion nur, indem man keine Metalle und Legierungen mehr einsetzt.
Die eingangs vorgenommene Beschreibung des Ablaufes korrosiver Prozesse zeigt deutlich, dass der Immersionstest zwar einfach, zumindest im ersten Teil der Bestimmung des Gewichtsverlustes ist, aber ein sehr weit entferntes Modell zur Bewertung der Korrosionsfestigkeit von Dentallegierungen darstellt.
Der Einsatz elektrochemischer Messmethoden ist zwingend und durch die Möglichkeiten des Einsatzes des MINI-Cell Systems (MCS) auch auf reale Bauteile anwendbar, realistisch und zukunftsweisend.
Hierfür sind jedoch noch eine Vielzahl von Untersuchungen erforderlich, um sowohl Messprotokoll als auch Grenzwerte klarer festlegen zu können.
Korrosion ist ein unterschätztes Phänomen!
- DIN – DEUTSCHES INSTITUT FÜR NORMUNG (2011): Zahnheilkunde - Korrosionsprüfverfahren für metallische Werkstoffe (ISO 10271:2011); Deutsche Fassung EN
- ISO 10271:2011, Beuth Verlag, Berlin.
- GRUNDIG, M. (2013): Vergleichende elektrochemische Untersuchungen zur Korrosionsstabilität dentaler Legierungen an Proben eines ISO Round Robin Tests, Diss., HU Berlin.
- MÜLLER, W.-D. (2009): Elektrochemische Charakterisierung metallischer Biomaterialien, Habilitationsschrift, Charité Universitätsmedizin Berlin.
- MÜLLER, W.-D. (2013): Korrosion als Folge einer falschen Verarbeitung, Vortrag, 5. Jahrestagung der DEGUZ, 8./9.6.2013, Frankenthal.
Autor
Prof. Dr. Wolf-Dieter Müller
Dankmarsteig 69
12524 Berlin
Tel.: 030 450 562769