Immunpathogenese der Parodontitis
Die Sichtweise auf die Pathogenese der Parodontitis hat sich in den letzten Jahren deutlich verändert. Während man früher von einem rein mikrobiologischen Problem ausging (Plaquehypothese), weiß man heute, dass die Parodontitis als chronisch entzündliche Erkrankung in ihrer Entstehung und Progression multifaktoriell bedingt ist. Man weiß heute, dass u.a. auch die individuelle Immunantwort eines Patienten entscheidend dafür ist, welche Folgen der auslösende Reiz (Biofilm) für den Entzündungsprozess hat. In mehr als 85 % der Fälle sind chronische bzw. agrressive Verlaufsformen der Parodontitis dadurch bedingt, dass das parodontale Entzündungssystem übersteigert auf das mikrobielle Keimspektrum reagiert (sogenannte Highresponder). In den verbleibenden Fällen können aber auch spezielle, mit einer verminderten Schleimhautresistenz einhergehende Immundefekte eine zu schwache Erregerabwehr bedingen und so ebenfalls zu fortschreitender parodontaler Destruktion führen.
Auch bei bester Mundhygiene ist eine Mundhöhle nie keimfrei. Die Mundhöhle ist die Haupteintrittspforte für alle mit der Nahrung oder über die Atmung aufgenommenen bakteriellen, viralen oder auch partikulären (Schadstoffe!) Antigene. Insofern ist es folgerichtig, dass das Immunsystem der Mundhöhle (d.h. auch des Zahnhalteapparates) nicht in gleicher Weise wie andere Organe unseres Körpers auf die Präsenz von Keimen oder Fremdmaterialien mit einer Entzündung reagieren kann. Im Gegenteil: Wie man heute weiß, ist die parodontale Entzündungsantwort ein sehr komplex regulierter Vorgang mit zahlreichen genetisch oder biochemisch bedingten „Stellschrauben“.
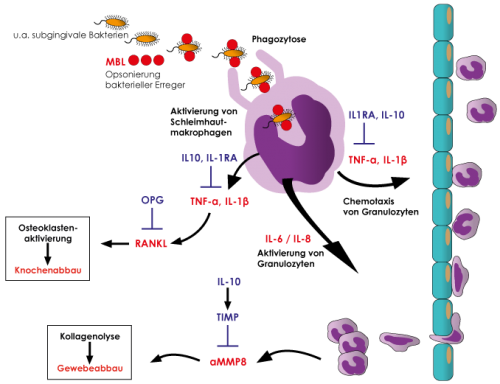
Der auslösende Reiz für die Entzündungskaskade ist (abgesehen von Material-bedingten Entzündungen) der subgingivale Biofilm. Durch das Saumepithel diffundierende bakterielle Mediatoren wie z.B. Lipopolysaccharide (LPS) aktivieren parodontal ansässige Makrophagen zur Sekretion proentzündlicher Zytokine, insbesondere Interleukin-1 (IL-1), Tumor Nekrose Faktor-alpha (TNFα) und Interleukin-6 (IL-6). Diese Zytokine bedingen eine lokale Aktivierung des Gefäßendothels, was die Infiltration weiterer Immunzellen in das Entzündungsgebiet fördert (Chemotaxis). Für das parodontale Entzündungsgeschehen sind die durch die genannten Zytokine initiierten Gewebe-destruktiven Vorgänge von zentraler Bedeutung. IL-1, TNFα und IL-6 aktivieren über eine Steigerung der RANKL-Expression die Osteoklasten, was mit einer erhöhten Alveolarknochenresorption einhergeht. Zusätzlich steigern diese Zytokine die Freisetzung der gewebeabbauenden Matrixmetalloproteinase 8 (MMP-8) durch Fibroblasten und Granulozyten, die heute mit hoher Präzision aus der Zahntasche messbar ist und einen wichtigen Prognosemarker darstellt.
Zur Verhinderung eines chronischen Entzündungsgeschehens wird die initiierte Entzündungs¬antwort im Normalfall durch die Ausschüttung der antientzündlichen Zytokine IL1-Rezeptorantagonist (IL1RN) und IL-10 gebremst. Beide Zytokine hemmen die IL-1-, TNF-α- und IL-6-Freisetzung und damit einhergehend deren proentzündlichen Effekte. IL-10 schützt zudem vor destruktiven Entzündungsvorgängen, in dem es über eine gesteigerte Freisetzung des MMP-8-Gegenspielers TIMP (Tissue Inhibitor of MMPs) den Gewebeabbau bremst. Zusätzlich verhindert IL-10 über die Induktion von Osteoprotegin (OPG) den Knochenabbau, da OPG die Wirkung von RANK an der Zielzelle somit die Osteoklastenaktivierung hemmt.
Die Entscheidung, ob es als Reaktion auf die Erregerantigene zu einer manifesten parodontalen Entzündungsantwort kommt oder nicht, wird somit durch das Verhältnis pro- und antientzündlicher Zytokine bestimmt. Mit welcher Intensität die Zytokine im Rahmen der Immunantwort freigesetzt werden, ist durch Polymorphismen in den Genen der Zytokine individuell festgelegt. Im Folgenden wird auf die klinisch relevanten Genpolymorphismen eingegangen, die nach aktuellem Stand der Literatur mit der Parodontitisprogression assoziiert sind.
Der enge Zusammenhang zwischen dem Schweregrad einer Parodontitis und der Konzentration lokaler Entzündungszytokine, insbesondere IL-1, ist vielfach beschrieben. Im entzündeten Parodontalgewebe und in der gingivalen Saumflüssigkeit kommt es zu einer erhöhten IL-1/IL1RN–Ratio. Das Interleukin-1-Gencluster auf Chromosom 2 umfasst die Gene für IL-1α (IL1A), IL-1β (IL1B) und den IL-1-Rezeptorantagonisten (IL1RN). Für zwei Polymorphismen im IL-1-Gen ist die funktionelle Bedeutung belegt. Der eine ist an Position –889 in der Promoterregion des IL1A-Gens (C/T), der zweite liegt an der Stelle -3953 (C/T) des IL1B-Gens. Liegt bei beiden Polymorphismen das T-Allel vor, kommt es zu einer gesteigerten IL-1-Synthese und damit einhergehend zu einer gesteigerten Entzündungskapazität. Diese Entzündungsaktivität wird noch zusätzlich verstärkt, wenn im IL1RN-Gen der Polymorphismus T–2018C vorliegt, der zu einer verminderten Freisetzung des antientzündlichen Gegenspielers IL1RN führt. Die genannten Genotypen zeigen eine enge Assoziation zur Parodontitis. So erhöht z.B. ein positiver IL-1-Genotyp die Häufigkeit des Zahnverlustes bei Rauchern um den Faktor 7,7. In der gleichen Studie wurde die Bedeutung der IL-1-Polymorphismen auch unabhängig vom Raucherstatus gezeigt.
Ein G/A-Polymorphismus an der Stelle –308 im Promoter des auf Chromosom 6 liegenden TNF-α-Gens geht mit einer bis zu siebenfach gesteigerten Expression dieses proentzündlichen Zytokins einher. Orale Schleimhautleukozyten von genetisch positiven Patienten mit Therapie-resistenter Parodontitis setzen TNF-α gesteigert frei und durch die Blockade von TNF-α durch lösliche Rezeptoren lässt sich die Entzündung und Knochenresorption hemmen. In einer Vielzahl von Studien konnte der TNF-α-Polymorphismus bei Patienten mit verschiedenen chronisch entzündlichen Erkrankungen in erhöhter Frequenz nachgewiesen werden. Dieses betrifft nicht nur die Parodontitis/Periimplantitis, sondern auch systemische Erkrankungen, die bekanntermaßen mit der Parodontitis in Assoziation stehen: Diabetes mellitus, chronisch entzündliche Darmerkrankungen sowie Arteriosklerose und Apoplexrisiko. In einer 2010 publizierten Studie wurde gezeigt, dass der -308G/A-TNF-α-Polymorphismus bei Patienten mit generalisierter Parodontitis signifikant häufiger auftritt als bei Patienten ohne Parodontitis.
Auf Grund der herausragenden Bedeutung der proentzündlichen Schlüsselzytokine TNF-und IL-1 sowie dessen Gegenspieler IL1RN für die individuelle Entzündungsneigung hat es sich durchgesetzt, anhand der erläuterten genetischen Konstellationen die Entzündungsprädisposition in 5 Graden darzustellen. So werden Patienten mit Entzündungsgrad 0 und 1 als Low-Responder bezeichnet, da eine normale oder allenfalls geringfügig erhöhte Entzündunsgkapazität vorliegt. Bei GRAD 3- und 4-Patienten, sogenannten Highrespondern, liegt hingegen eine signifikant erhöhte Entzündungsneigung und somit ein erhöhtes Risiko für chronische und aggressive Verlaufsformen der Parodontitis vor.
Auch wenn das Ausmaß der initialen Entzündungsantwort vor allem durch TNF-α und IL-1 bestimmt wird, spielen weitere Zytokine in der Modulation eine bedeutende Rolle.
Das proinflammatorische Zytokin Interleukin-6 wird u.a. von Makrophagen, Fibroblasten, Epithelzellen und T-Zellen sezerniert. IL-6 steigert die MMP-8-Freisetzung und die Knochenresorption. Die IL-6-Expression korreliert nachweislich mit dem Attachmentverlust. Eine erhöhte IL-6-Expression ist nicht nur bei der Parodontitis, sondern auch bei anderen chronisch entzündlichen Erkrankungen wie z.B. der Rheumatoid-Arthritis gezeigt. Bei einer erfolgreichen Parodontaltherapie geht die IL-6-Sekretion deutlich zurück. Ein C/G-Polymorphismus an der Stelle -174 im Promoter des auf dem Chromosom 7 liegenden Gens geht mit einer erhöhten IL-6-Freisetzung einher. In Studien wurde das G-Allel daher mit chronischen und auch aggressiven Parodontitisverläufen assoziiert. Die Tatsache, dass bei Trägern des IL-6-C/G-Polymorphismus (erhöhte IL-6-Sekretion) erhöhte Keimlasten an Aggregatibacter actinomycetemcomitans und Porphyromonas gingivalis gefunden wurden, verdeutlicht, dass eine genetisch bedingt zu starke Entzündungsantwort nicht etwa wie zu erwarten mit einer verstärkten Keimelimination in der Zahntasche einhergeht, sondern dass die unkontrolliert gesteigerte Entzündung eher für eine Keimpersistenz prädisponiert.
Interleukin-10 (IL-10) wird neben dem IL1-Rezeptor-Antagonist (IL1RN) als antiinflammatorisches Zytokin bei einer Entzündungsreaktion zeitversetzt von Makrophagen sezerniert. IL-10 schützt vor destruktiven Entzündungsvorgängen, in dem es einerseits über eine gesteigerte TIMP-Freisetzung (Gegenspieler des MMP-8) Gewebeabbau bremst und anderseits über die OPG-Induktion (Gegenspieler des RANK) den Knochenabbau verhindert. Der Polymorphismus C-592A im auf dem Chromosom 1 liegenden IL10 Gen wurde in einer Vielzahl von Studien mit der Progression der Parodontitis assoziiert. Er geht mit verminderten IL-10-Spiegeln einher. Claudino et al. konnte zeigen, dass der Polymorphismus hetero- und homozygot verändert (CA und AA) signifikant gehäuft bei Parodontitispatienten vorkommt. Er wies zudem nach, dass bei Trägern des A-Allels die verminderte IL-10-Freisetzung mit deutlich niedrigeren Mengen an TIMP-3 und OPG sowie erhöhter Knochenresorption, gesteigerte Gewebedestruktion und Zunahme der Taschentiefen einhergeht.
Im Rahmen der immunologischen Infektabwehr werden die parodontopathogenen Bakterien phagozytiert und abgetötet. Voraussetzungen dafür sind Erkennen und Binden (Opsonierung) der Erreger. Die Beladung der Keime mit körpereigenen Proteinen (Antikörper, Komplementfaktoren, Mannan-binding Lectin MBL) verbessert die Erkennung der Keime durch die parodontalen Makrophagen. Vorallem in den Fällen einer chronisch progredienten Parodontitis bei denen eine gesteigerte Entzündungsneigung ausgeschlossen wurde, können Defekte in diesen unspezifischen Immunmechanismen (Opsonierung, Phagozytose) und die damit einhergehende verminderte Erregerabwehr ursächlich sein. Bei der Abwehr von Infektionen auf Schleimhäuten spielt IgA eine zentrale Rolle. Der selektive IgA-Mangel ist mit einer Prävalenz von 1:500 der häufigste Immundefekt überhaupt. Eine weitere wichtige Komponente der unspezifischen first line defense ist das MBL (Mannose-bindendes Lectin). Es besitzt eine hohe Affinität für repetitive Mannose-haltige Kohlenhydratverbindungen auf der Oberfläche von zahlreichen Bakterien und Pilzen. Daher bindet es auf die parodontopathogenen Bakterien und löst damit eine Antikörper-unabhängige Aktivierung des Komplementsystems aus (Lectin-pathway of complement activation). Dieses bedingt eine schnelle Eliminierung der Erreger im Parodont, was wiederum verstärkte Entzündungsgeschehen limitiert. Es sind 3 funktionell relevante Polymorphismen für das auf dem Chromosom 10 liegenden MBL-Gen bekannt (R52C = Allel D, G54D = Allel B und G57E = Allel C). In einer Studie von Tsutsumi et al. entwickelten Träger des B-Allels häufiger schwere Parodontitisverläufe im Vergleich zu Nicht-Allel-Trägern. In seltenen Fällen können auch Funktionsdefekte der Granulozyten (v.a. Phagozytosedefekte) für eine chronische Parodontitis verantwortlich sein.
Durch Korrosion von Dentalllegierungen oder durch eine unvollständige Polymerisation von Kunststoffen gelangen immer potentielle Allergene in den Speichel. Bei Patienten, die auf die enthaltenen Metalle oder Acrylate sensibilisiert sind, können parodontale Entzündungsreaktionen in allen vom Speichel erreichten Schleimhautbereichen induziert werden. Auf Grund der bei Sensibilisierungen eintretenden immunologischen Verstärkungsmechanismen treten die Immunreaktionen schon bei geringen Fremdstoffmengen im Speichel auf die weit unter den toxikologisch relevanten Grenzen liegen. Die verteilende Wirkung des Speichels erklärt, warum diese parodontalen Entzündungen nicht zwingend nur an der Kontaktstelle auftreten sondern ein generalisiertes Entzündungsgeschenen sogar typisch ist. Zweifelsohne spielen selbst in diesen Fällen parodontale Erreger bzw. Lipopolysaccharide eine wichtige katalysierende Rolle, die persistierende Auseinandersetzung des Immunsystems stellt aber nicht selten den Grund für eine ungewöhnliche Therapieresistenz dar. Eine Diagnostik erfolgt mit dem Lymphozytentransformationstest (LTT) oder mit dem Basophilen-Degranulationstest (BDT).
Unter Berücksichtigung der dargestellten Tatsachen wird deutlich, dass die Parodontitis nicht als ein ausschließlich infektiologisches sondern vielmehr als ein immunologisches Geschehen angesehen werden muss. Aus der Kenntnis der Immunpathogenese der Parodontitis ergeben sich labordiagnostische Strategien, mittels derer die Abklärung der Frage erfolgen kann, ob eine übersteigerte bzw. verminderte Erregerabwehr oder Werkstoffunverträglichkeiten ursächlich sind für z.B. chronische Verläufe oder eine fortschreitende parodontale Destruktion trotz initialer Therapie. Diese Ursachenabklärung hat weitreichende therapeutische Folgen.
Autor
Dr. rer. nat. Sabine Schütt
Nicolaistraße 22
12247 Berlin
Tel.: 030 770 01-220