Toxische Effekte von Metallen im Organismus
Peter Jennrich
Die tägliche Exposition gegenüber potentiell toxischen Metallen besteht aus Aluminium, Blei, Cadmium, Nickel, Quecksilber, Titan, Zinn und weiteren Elementen, die aus unterschiedlichen Quellen stammen. Zahnmetalle stellen eine besondere Expositionsquelle dar, da sie über lange Zeit Metallionen in den Körper abgeben können. Oberflächenbeschaffenheit, Phasenstruktur, umgebendes Milieu, Wärmebehandlung und die Legierungszusammensetzung wirken sich auf das unterschiedliche Korrosionsverhalten von Dentallegierungen aus. Metallionen können im Körper sowohl zu immunologischen als auch zu toxischen Reaktionen führen. Zu ersteren zählen die Aktivierung oder Hemmung von T- und B-Lymphozyten und die Ausschüttung von entzündungsfördernd wirkenden Botenstoffen wie Tumornekrosefaktor alpha (TNFα), Nukleärer Faktor kappa B (NF-κB), Interferon gamma (INFγ) und Interleukinen (IL 1β; IL 6). Zu den toxischen Reaktionen zählen die Bildung freier Radikale, die Hochregulierung von Stickoxiden, sowie die Verdrängung von essentiellen Mineralien und Spurenelementen, die als toxische Mimikry beschrieben ist. Die Folge können zytotoxische Effekte an der Zellmembran, im Zytoplasma, im Zellkern, in den Mitochondrien und an Hormonrezeptoren sein. Um den Einfluss von Zahnmetallen auf den Gesamtorganismus richtig einzuschätzen, stehen neben verschiedenen in-vitro Methoden auch individuelle Untersuchungen des Patienten zur Verfügung. Die Abgabe der Metalle beim Kauvorgang im Speichel lässt sich ebenso bestimmen, wie eventuelle Sensibilisierungen des Patienten gegenüber einem oder mehreren Zahnmetallen. Die Ergebnisse eines Provokationstestes mit DMPS oder anderen Chelatbildnern ermöglichen als Multielementanalyse einen Einblick in die Gesamtbelastung des Organismus mit potentiell toxischen Metallen. Um den pathophysiologischen Prozessen, die durch Metalle im Körper ausgelöst werden, Einhalt zu gebieten, wird neben einer eventuellen Sanierung der Zahnmetalle auch die systemische Entlastung des Organismus mit Chelatbildnern empfohlen.
Die Angaben über die durchschnittliche tägliche Aufnahme potentiell toxischer Metalle sind abhängig von Umwelteinflüssen und Ernährungsgewohnheiten. So gibt es zwar unterschiedliche Aussagen bezüglich der Höhe der zugeführten Metalle, Einverständnis besteht jedoch dahingehend, dass wir im täglichen Leben eine Exposition gegenüber mehreren Metallen gleichzeitig zu verzeichnen haben (Tab.1).
Nach der Aufnahme in den Körper erfolgt der Transport der Metalle innerhalb des Körpers überwiegend durch das Blutgefäßsystem. So gelangen die potentiell toxischen Metalle entweder in die Leber und in die Nieren, um ausgeschieden zu werden, oder sie gelangen in das Nervensystem, in das Skelettsystem, in das endokrine System oder in andere kritische Zielorgane. Dort können sie im Laufe von Jahren akkumulieren, bis eine Konzentration erreicht wird, die zu funktionellen und strukturellen Veränderungen führt (JENNRICH 2007).
Die Aufnahme der Metalle erfolgt über die Haut, sowie die Schleimhäute des Magen-Darm-Traktes und der Atemwege. Kleidungsstücke, Schuhe, Deodorantien, Kosmetika, Münzen und Tattoos sind Expositionsquellen für eine direkte Absorption durch die Haut. Metalle, die in Hausstaub, Straßenstaub, Rauch, Abgasen, Toneremissionen enthalten sind oder am Arbeitsplatz die Luft belasten, führen zur Aufnahme über die Nasen- und Bronchialschleimhaut. Trinkwasser, alkoholische und nicht alkoholische Getränke, Lebensmittel und Lebensmittelzusatzstoffe, Medikamente und deren Zusatzstoffe, Zahncreme und Zahnersatzmaterialien sind Medien, durch die Metalle in den Magen-Darm-Trakt gelangen. Die Barriere einer intakten Darmschleimhaut stellt einen gewissen Schutz gegenüber einer Metallaufnahme dar. So geht man davon aus, dass von den durchschnittlichen 5-10 mg Aluminium, die über Nahrung und Trinkwasser in den Körper gelangen, nur circa 0,1-0,3 % resorbiert werden (NIEBOER et al. 1995, PRIEST 1993). Ist jedoch die Barrierefunktion der Darmschleimhaut aufgrund einer medikamentösen Behandlung, einer chronischen Entzündung, einer Nahrungsmittelallergie oder einer Dysbiose beeinträchtigt, so ist mit einer erhöhten Aufnahme von Metallen durch die Darmschleimhaut zu rechnen.
| Potentiell toxisches Metall | Quelle: REICHL 2000 | Quelle: LLOBET et al. 2003 |
|---|---|---|
| Arsen | 11 µg | 223 µg |
| Blei | 200 µg | 28 µg |
| Cadmium | 50 µg | 15 µg |
| Nickel | 500 µg | nicht gemessen |
| Quecksilber | 8-16 µg | 21 µg |
Einen Sonderfall stellen die Zahnmetalle dar. Sie werden teils direkt in den Kieferknochen eingebracht oder sind in der Mundhöhle einer ständigen hohen mechanischen Belastung durch den Kauvorgang sowie der ständigen Einwirkung von Speichel, Nahrungsmitteln und Getränken ausgesetzt.
Dadurch entstehen Abrieb und Korrosion, die zu einer Freisetzung von Metallionen führen. Die implantierbaren Titan- oder Cobalt-Chrom–Legierungen können Metallionen direkt in den Kieferknochen abgeben. Darüber hinaus ist das Skelettsystem inklusive der Kieferknochen ein Speicherorgan für potentiell toxische Elemente wie Blei, Cadmium und Aluminium. Die Halbwertszeit der Metalle im Knochen beträgt oft Jahrzehnte. So bildet Blei im Knochen und in den Zähnen mit Phosphat schwerlösliches Bleiphosphat, und bleibt dort lange Zeit gespeichert. Man rechnet mit einer Halbwertszeit von bis zu 30 Jahren (REICHL 2002). Auch Aluminium neigt bei wiederholter Aufnahme geringer Mengen aufgrund der langen Halbwertszeit von 29 Jahren zur Akkumulation im Skelettsystem (PRIEST 2004) Diese bereits im Kiefer befindlichen Metalle können womöglich nach dem Setzen von Zahnimplantaten mit den Implantatmaterialien in Wechselwirkung treten und deren Toxizität deutlich erhöhen. Diese Vermutung liegt nahe, wenn man bedenkt, dass die Kombination einer ungiftigen Menge von Titandioxid (TiO2) mit einer ungiftigen Menge von Bleiacetat zur Erhöhung des oxidativen Stresses führt und zytotoxisch wirkt (DU et al. 2012). Auch nicht-metallische Toxine können bereits in geringer Dosierung in Wechselwirkung mit TiO2 treten und zu toxischen Effekten führen. Die Kombination einer ungiftigen Menge von Nano-Titandioxid mit Bisphenol A führt zu toxischen Effekten und einer erhöhten Bildung von freien Radikalen, DNA-Doppelstrangbrüchen und Mikronuklei (ZHENG et al. 2012)
Auch ohne die Verstärkung durch Co-Faktoren besitzt TiO2 ein toxisches Potential. So liegt ein ausreichender experimenteller Nachweis der Karzinogenität von TiO2 bei Säugetieren vor. Ein elementarer Schwachpunkt der Tierversuche ist, dass sie nicht auf den Menschen übertragen werden (können). Da bei der Bewertung der Kanzerogenität eines Stoffes für den Menschen andere Kriterien gelten, ist der Nachweis des krebserzeugenden Potentials von TiO2 beim Menschen, der weit mehr als nur einem Toxin ausgesetzt ist, weit schwieriger. Eine monokausale Einwirkung findet de facto nicht statt. Andere bekannte und unbekannte Einflussfaktoren, die die Mortalität beeinflussen, müssen stets berücksichtigt werden. Dennoch hat die International Agency for Research on Cancer (IARC) auf der Basis des aktuellen wissenschaftlichen Kenntnisstandes Titandioxid als möglicherweise krebserregend für den Menschen (Gruppe 2B) eingestuft (IARC 2010). Für Arbeiter, die TiO2 verarbeiten, hat das National Institute for Occupational Safety and Health der USA ultrafeine TiO2-Partikel als ein potentielles berufliches Karzinogen bewertet (NIOSH 2011).
Es gibt Hinweise, dass Speichel in geringem Maß Metallionen aus Zahnmetallen löst, die im Laufe der Zeit im Körper akkummulieren und zu funktionellen Organbeschwerden und zu schweren Krankheiten führen können (KALICANIN & AJDUKOVIC 2008). Verschiedene Faktoren haben einen Einfluss auf die Höhe der Korrosion. So zum Beispiel der Einsatz von Wasserstoffperoxid zum Bleichen von Zähnen. Bei vorhandenen Amalgamfüllungen kommt es dabei zu einer erhöhten Freisetzung von Quecksilber (AL-SALEHI 2009). Auch Materialien, die meist als unbedenklich angesehen werden, können unter bestimmten Bedingungen Ionen abgeben. So wurde unter Einwirkung von Fluor und niedrigen pH-Werten ein extremer Anstieg der Ionenfreisetzung aus titanhaltigen Zahnmaterialien beobachtet (STRIETZEL et al. 1998). Großen Einfluss auf die Korrosionsanfälligkeit hat die Zusammensetzung der Metalllegierungen (siehe Abb. 1).
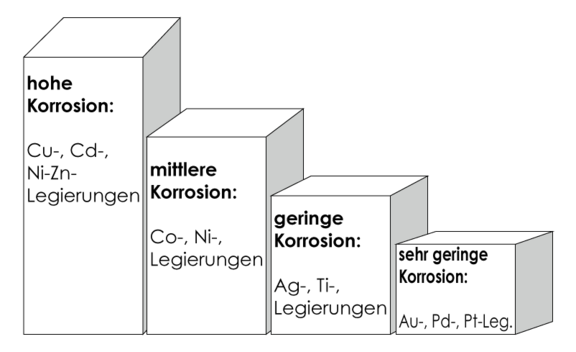
Kationen, die durch Korrosion freigesetzt werden, können inflammatorische Reaktionen hervorrufen und die Immunantwort durch Aktivierung oder Hemmung von T- und B-Lymphozyten beeinflussen. Nickel und Zink können T- und B-Lymphozyten aktivieren (WARNER & LAWRENCE 1988). Sehr geringe Konzentrationen von Zink, Nickel und Cobalt stimulieren die Leukotrien B4 Freisetzung in vitro als Folge einer Aktivierung von polymorphkernigen neutrophilen Granulozyten (KLEIN et al.1994). Cadmium und Kupfer hingegen können die Aktivität der antigen-präsentierenden B-Lymphozyten und Makrophagen hemmen (SMITH & LAWRENCE 1988). Auf lokaler Ebene überwiegen inflammatorische Reaktionen, die durch die Metallionen in der Mundhöhle ausgelöst werden. Sie umfassen die Gingivitis, Stomatitis, Glossodynie sowie allergische und lichenoide Reaktionen.
Zytotoxische Effekte der Ionen, die von Zahnmetallen freigesetzt werden, können den benachbarten Alveolarknochen schädigen. Dabei haben Chrom-Ionen (Cr6+) nach einer Inkubationszeit von 48 Stunden die stärksten Auswirkungen auf die Knochenmarkszellen. Mittlere Zytotoxische Effekte wurden beobachtet mit Cobalt- (Co2+), Molybdän- (Mo6+) und Nickelionen (Ni2+), während Titan- (Ti4+), Aluminium- (Al3+), Vanadium- (V5+) und Manganionen (Mn2+) nur leichte zytotoxische Effekte zeigten (PULEO & HUH 1995).
Beachtet werden muss jedoch, dass es je nach Versuchsaufbau, Versuchsbedingungen und verwendeten Materialien teilweise große Unterschiede im toxischen Ranking der Zahnmetalle gibt. So zeigen verschiedene Zelllinien ein ganz unterschiedliches Verhalten gegenüber toxischen Metallen (WATAHA et al. 1994). Dementsprechend gibt es Forderungen klinisch relevante (menschliche) Zell-Linien zu verwenden, um möglichst genaue prä-klinische Informationen zu erreichen, die über ein reines toxischen Ranking hinausgehen.
Zahnmetallionen können auch ins Blutsystem aufgenommen werden und systemisch verteilt werden. Ni2+ und Co2+ werden an Albumin gebunden im Gefäßsystem transportiert (TRAISNEL et al 1990).
Diese Ionen besitzen die Fähigkeit eine Genaktivierung in menschlichen Gefäßendothelzellen zu induzieren, die ähnlich der von proinflammatorischen Mediatoren wie IL-6 und IL-8 ist (WAGNER et al 1998). Aluminium wird nach der Resorption durch die Schleimhaut im Blut vorwiegend an Transferrin gebunden und im Körper verteilt (REICHL 2002). In das Zentrale Nervensystem gelangt Aluminium durch Überwindung der Blut-Hirn-Schranke. Dies geschieht nicht durch einfache Diffusion, sondern durch einen Carrier-vermittelten Transport. Im zentralen Nervensystem befindet sich Aluminium entweder in der Extrazellulärflüßigkeit, oder es bindet an Eiweiße der Nervenzellwände, oder es wird in die Nervenzellen aufgenommen. Der Zellkern, das Zytoplasma, die Mitochondrien und das endoplasmatische Retikulum sind intrazelluläre Aluminiumspeicher (TOMLJENOVIC 2011).
Beachtenswert sind Ergebnisse die zeigen, dass Aluminium nach Injektion aluminiumhaltiger Impfstoffe von Makrophagen resorbiert und systemisch verteilt wird und über diesen Weg in Lymphknoten, Milz, Leber und das Zentrale Nervensystem gelangt (KHAN et al 2013). Die These, dass dies ein Pfad ist, über den auch Zahnmetallionen im Körper verteilt werden, ist zwar nicht bewiesen, aber plausibel.
Auf zellulärer Ebene konkurrieren potentiell toxische Elemente und essentielle Mineralien um Bindungsstellen. Im Zusammenhang mit der Untersuchung des Einflusses von Metallen auf die Karzinogenese wurde berichtet, dass Blei-, Beryllium-, Cadmium-, Mangan-, Kobalt-, Nickel- und Quecksilberionen die essentiellen Elemente Magnesium, Calcium, Eisen, Kupfer und Zink nachahmen und verdrängen können. Die Folge ist ein Funktionsverlust von kleinen Molekülen, Enzymen und Nukleinsäuren (JENNETTE 1981).
Aluminium-, Quecksilber-, Methylquecksilber- und Bleiionen, die extrazelluär zugeführt werden, verringern den Ca-Einstrom über spannungsabhängige Calciumkanäle (BUSSELBERG 1995). Da Calcium als second-messenger wichtig ist für die Steuerung von Zellfunktionen durch Hormone und Transmitter, führt eine Verringerung des Calciumeinstroms in die Zelle zu einer Beeinträchtigung der Muskelkontraktion, der Synthese und Sekretion von Neurotransmittern und Hormonen, der Genexpression, der Regulation von Enzymaktivitäten und der Regulation von Ionen-Pumpen.
Unter dem Einfluss potentiell toxischer Metalle werden freie Sauerstoffradikale gebildet, die wiederum Redox-Systeme beeinträchtigen und zur Lipidperoxidation führen. Folgen sind ein Anstieg von DNA Schäden, ein Anstieg der Bildung von DNAProtein-Querverbindungen und eine unangemessene Aktivierung von zellulären Signalwegen (z.B. NF-κB).
So können bei pathologisch erhöhter Eisen- und Kupferspeicherung DNA-Schäden in der Leber entstehen, die mit der Entstehung eines Hepatozellulären Karzinoms assoziiert sind (NAIR et al. 1998).
Neben der ROS-vermittelten Toxizität der Metalle besteht auch ein direkter Einfluss auf Hormonrezeptoren. Quecksilber, Nickel, Chrom, Kobalt, Kupfer, Zinn und Blei wirken auf den Östrogenrezeptor ein und stimulieren das Wachstum von menschlichen Brustkrebs-Zellen (MARTIN et al. 2003). Eine chronisch niedrig dosierte Exposition gegenüber Karzinogenen aus der Umwelt ist eine der Hauptursachen für eine Tumorerkrankung. Mehr als 375 identifizierte oder potentielle karzinogene Umweltschadstoffe wurden bislang erfasst. Viele von ihnen sind Metalle oder Metallverbindungen (IARC 2004). Arsen und anorganische Arsenverbindungen, Beryllium und Berylliumverbindungen, Cadmium und Cadmiumverbindungen, Chrom(VI)-Verbindungen und verschiedene Nickelverbindungen sind von der IARC als krebserregend für den Menschen eingestuft (Gruppe I). Anorganische Bleiverbindungen sind als wahrscheinlich krebserregend (Gruppe 2A), Kobalt und Kobaltverbindungen, Methylquecksilberverbindungen, Titandioxid und Implantate, die metallisches Kobalt, metallisches Nickel und ein Legierungspulver aus 66-67 % Nickel, 13-16 % Chrom und 7 % Eisen enthalten, sind als möglicherweise krebserregend für den Menschen (Gruppe 2B) klassifiziert. Gäbe es entsprechend der IARC Abteilungen der WHO, die die neurotoxischen und kardiotoxischen sowie die immunologisch schädlichen Substanzen klassifizieren würden, so würden sich auch hier viele Metalle und Metallverbindungen wiederfinden.
Die Vielzahl der unterschiedlichen Expositionsquellen macht deutlich, dass im Laufe von Jahren allein dadurch die Alltagsbelastungen zumindest für vulnerable und genetisch suszeptible Menschen eine individuell nicht mehr tolerierbare Gesamtbelastung entstehen kann. Besonderes Augenmerk muss den Mehrfachbelastungen gelten. Von ihnen geht ein potentielles Risiko aus, dass sich durch einzelne Grenzwerte oder konventionelle toxikologische Kriterien nicht sicher vorhersagen lässt. Die Vielzahl der unterschiedlichen Pathomechanismen, die von verschiedenen Zahnmetallen und weiteren potentiell toxischen Metallen ausgelöst werden, macht verständlich, dass Aussagen, wieviel Quecksilberabrieb von Amalgamfüllungen oder wieviel Korrosion von Zahnmetallen wie Cobalt, Chrom oder Nickel toleriert werden kann, nicht ohne weiteres möglich sind. Dies macht deutlich, dass Strategien notwendig sind, um die Bioakkumulation potentiell toxischer Metalle in der Natur, sowie ihre Anreicherung in der Nahrungskette und im menschlichen Körper zu verhindern. Präventive gesundheitspolitische Maßnahmen zur Reduzierung der menschlichen Belastung durch diese schädlichen Substanzen haben Priorität (JENNRICH 2011). Dazu zählt neben einer möglichst guten zahnmedizinischen Versorgung die Dekorporierung von bereits akkumulierten Metallen.
Die Frage, ob und wann eine Ausleitung potentiell toxischer Metalle aus dem Körper medizinisch sinnvoll ist, wird kontrovers diskutiert. Bei einer Informationsveranstaltung zur potentiellen Belastung der Bevölkerung von Wonfurt/Unterfranken durch einen ortsansässigen Elektroschrott-Recycling Betrieb, sagte ein Toxikologe der Universität Erlangen: „Wenn Komplexbildner zur Analytik eingesetzt werden, sind normale Referenzwerte nicht mehr heranzuziehen. Beim Einsatz von Komplexbildnern werden immer viel höhere Werte gemessen, da jeder eine Belastung hat“ (JENNRICH 2012). Dennoch halten weder die Beratungskommission der Deutschen Gesellschaft für Pharmakologie und Toxikologie (DGPT) noch das Umweltbundesamt (UBA) den Einsatz von Komplex-und Chelatbildnern in der Umweltmedizin für notwendig (DGPT 1990, UBA 1999). So betont das UBA zwar, dass DMPS und DMSA gut wirksam, gut verträglich, relativ spezifisch, leicht zu verabreichen und für die Behandlung akuter Metallvergiftungen unverzichtbar geworden sind, nicht jedoch für die „Anwendung bei vermeintlichen chronischen Metallvergiftungen, wie sie in der Umweltmedizin zum Teil praktiziert wird“. Dabei wird leider die Bedeutung von chronischen Metallbelastungen und -vergiftungen, die sich über Jahre und Jahrzehnte entwickeln können, völlig übersehen. Seit Fritz Haber ist bekannt, dass sich bei Summationsgiften toxische Effekte auch bei geringer Konzentration aber langer Exposition einstellen (WITSCHI 1999). Somit entscheidet nicht allein die Dosis darüber, ob eine Substanz giftig ist, sondern auch die Zeit, mit der sie auf den Körper ein wirkt. Quecksilber, Blei, Cadmium und andere potentiell toxische Metalle zählen zu den Summationsgiften. Entsprechend ist davon auszugehen, dass sich toxische Effekte dieser Elemente auch bei geringer Exposition im Laufe von Monaten und Jahren einstellen. Wie sollen diese chronischen Belastungen und Vergiftungen behandelt werden? Ist es nicht naheliegend, die chronischen Belastungen, die zu akuten Effekten führen, zu diesem Zeitpunkt dann auch wie eine akute Metallvergiftung zu behandeln? Doch vor der Therapie steht die Diagnostik. Um einen Einblick in die Ganzkörperbelastung des Patienten zu erhalten, werden in der klinischen Umweltmedizin und Metalltoxikologie Komplex- und Chelatbildner als Diagnostikum eingesetzt.
Die Mitglieder der Amalgam-Arbeitsgruppe der Kommission „Methoden und Qualitätssicherung in der Umweltmedizin“ des Robert Koch-Instituts behaupten hingegen, die Mobilisation von Quecksilber durch Komplexbildner vor einer Messung im Urin (z. B. DMPS-Test) sei für die patientenbezogene umweltmedizinische Diagnostik nicht geeignet. Auch der „Kaugummitest“ mit nachfolgender Quecksilberbestimmung im Speichel sei zur Überprüfung einer Hg-Belastung aus Amalgamfüllungen nicht geeignet, da dabei auch nicht resorbierbares Quecksilber, z. B. aus Legierungspartikeln, erfasst werde (RKI 2007). Prof. Dr. F. Daschner und Dr. J. Mutter waren, damals als Vertreter des Institutes für Umweltmedizin und Krankenhaushygiene des Universitätsklinikums Freiburg, anfänglich ebenfalls an der Erarbeitung der Stellungnahme beteiligt. Da sie in einigen Punkten abweichende Auffassungen vertraten, haben sie aber der endgültigen Version der Kommissionsstellungnahme nicht zugestimmt.
Bereits 1998 veröffentlichte H.V. Aposhian seine Ergebnisse zur Mobilisation von Quecksilber und Arsen beim Menschen durch DMPS im monatlich erscheinenden peer-reviewed Journal des amerikanischen National Institute of Environmental Health Sciences, National Institutes of Health, und des U.S. Department of Health and Human Services (APOSHIAN 1998). Er zeigte, dass durch den DMPS-Provokationstest die Ausscheidung von Quecksilber im Urin bei Zahntechnikern 88mal größer war als im Spontanurin vor der DMPS-Gabe. Bei Zahnärzten waren die Quecksilberwerte im Urin 49mal und bei Amalgamträgern 35mal höher, als ohne Provokation. Unter den Aspekten der Prävention und des Vorsorgeprinzips reicht es nicht aus, den DMPS Provokationstest mit der Feststellung abzulehnen, dass danach die Werte immer höher seien als bei der Spontanausscheidung. Vielmehr sollte er als hilfreiche diagnostische Methode zum Nachweis oder zum Ausschluss chronischer Metallbelastungen etabliert werden.
Da Metalle wie Quecksilber, Zinn, Cadmium, Blei und Aluminium durch ihre Kombinationswirkung schon bei geringster Dosierung toxische Effekte erzielen können (BELLES et al. 2002, INSTITORIS et al. 2006, SCHUBERT et al. 1978), sind Strategien für den Einsatz von wirksamen, gut verträglichen, relativ spezifischen und leicht zu verabreichenden Antidoten in der Umweltmedizin zu fordern. Diese sind durch den therapeutischen Einsatz von Komplex- und Chelatbildnern möglich.
Werden zur Ausleitung von Zahnmetallen andere Methoden als die Gabe von Komplexbildnern eingesetzt, so bedarf es auch hierbei einer Laborkontrolle wie hoch die Belastung vor und nach der Therapie war, um deren Notwendigkeit und Effektivität nachzuweisen. Ansonsten sind sie als unspezifische Maßnahmen zu werten, deren Wirksamkeit ungeprüft bleibt.
- AL-SALEHI SK. (2009): Effects of bleaching on mercury ion release from dental amalgam. J Dent Res. 88(3): 39-43.
- APOSHIAN HV. (1998): Mobilization of mercury and arsenic in humans by sodium 2,3-dimercapto-1-propane sulfonate (DMPS). Environ Health Perspect. 106(Suppl 4): 1017–1025.
- BELLES M, ALBINA ML, SANCHEZ DJ et al. (2002): Interactions in developmental toxicology: effects of concurrent exposure to lead, organic mercury, and arsenic in pregnant mice. Arch Environ Contam Toxicol. 42(1): 93-98.
- BORDIGNON V, PALAMARA F, CORDIALI-FEI P et al. (2008): Nickel, palladium and rhodium induced IFN-gamma and IL-10 production as assessed by in vitro ELISpotanalysis in contact dermatitis patients. BMC Immunol. 9: 19.
- BUSSELBERG D. (1995): Calcium channels as target sites of heavy metals.Toxicol Lett. 82-83: 255-261.
- DGPT - DEUTSCHE GESELLSCHAFT FÜR PHARMAKOLOGIE UND TOXIKOLOGIE (1990): Stellungnahme zur Toxizität von Zahnfüllungen aus Amalgam. Beratungskommission Toxikologie der DGPT. Mitteilungen 1990(5): 24-26. Nachdruck: Med Klin 85: 350-352.
- DU H, ZHU X, FAN C, XU S, WANG Y, ZHOU Y. (2012): Oxidative damage and OGG1 expression induced by a combined effect of titanium dioxide nanoparticles and lead acetate in human hepatocytes. Environ Toxicol. 27(10): 590-597.
- FOURNIE GJ, MAS M, CAUTAIN B et al. (2001): Induction of autoimmunity through bystander effects. Lessons from immunological disorders induced by heavy metals. J Autoimmun. 16(3): 319-326.
- HALLAB NJ, CAICEDO M, FINNEGAN A et al. (2008): Th1 type lymphocyte reactivity to metals in patients with total hip arthroplasty. J Orthop Surg. 3: 6.
- IARC - INTERNATIONAL AGENCY FOR RESEARCH ON CANCER (2010): Carbon black, titanium dioxide, and talc. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Vol. 93. International Agency for Research on Cancer, World Health Organization, Lyon, France.
- IARC - INTERNATIONAL AGENCY FOR RESEARCH ON CANCER (2004): Overall Evaluations of Carcinogenicity to Humans As evaluated in IARC Monographs Volumes 1-88. International Agency for Research on Cancer, World Health Organization, Lyon, France. www-cie.iarc.fr/monoeval/crthall.html (link funktioniert nicht!
- INSTITORIS L, KOVACS D, KECSKEMETI-KOVACS I et al. (2006): Immunotoxicological investigation of subacute combined exposure with low doses of Pb, Hg and Cd in rats. Acta Biol Hung. 57(4): 433-439.
- JENNETTE KW. (1981): The role of metals in carcinogenesis: biochemistry and metabolism. Environ Health Perspect. 40: 233-252.
- JENNRICH P. (2007): Schwermetalle – Ursache für Zivilisationskrankheiten. CO`MED Verlagsgesellschaft mbH, Hochheim.
- JENNRICH P. (2011): Europarat ruft dazu auf, die Umweltbelastung durch Schwermetalle zu reduzieren. COMED 07/2011: 1-5.
- JENNRICH P. (2012): Persönliche Aufzeichnungen: Kreisbürgerversammlung in Wonfurt 26.06.2012.
- KALICANIN B, AJDUKOVIC Z. (2008): Influence of saliva medium on freeing heavy metal ion from fixed dentures. Sci Total Environ. 397(1-3): 41-45.
- KATIYAR S, AWASTHI SK, SRIVASTAVA JK. (2009): Effect of chromium on the level of IL-12 and IFN-gamma in occupationally exposed workers. Sci Total Environ. 407(6):1868-1874.
- KHAN Z, COMBADIÈRE C, AUTHIER FJ et al. (2013): Slow CCL2-dependent translocation of biopersistent particles from muscle to brain. BMC Med. 11: 99. doi:10.1186/1741-7015-11-99.
- KLEIN CL, KÖHLER H, KIRKPATRICK CJ. (1994): Increased adhesion and activation of polymorphonuclear neutrophil granulocytes to endothelial cells under heavy metal exposure in vitro. Pathobiology. 62(2): 90–98.
- LLOBET JM, FALCÓ G, CASAS C et al. (2003): Concentrations of arsenic, cadmium, mercury, and lead in common foods and estimated daily intake by children, adolescents, adults, and seniors of Catalonia, Spain. J Agric Food Chem. 51(3): 838-842.
- MARTIN MB, REITER R, PHAM T et al. (2003): Estrogen-like activity of metals in MCF-7 breast cancer cells. Endocrinology. 144(6): 2425-2436.
- NAIR J, CARMICHAEL PL, FERNANDO RC et al. (1998): Lipid peroxidation-induced etheno-DNA adducts in the liver of patients with the genetic metal storage disorders Wilson's disease and primary hemochromatosis. Cancer Epidemiol Biomarkers Prev. 7(5): 435-440.
- NIEBOER E, GIBSON BL, OXMAN AD, KRAMER JR. (1995): Health effects of aluminium: a critical review with emphasis on aluminium in drinking water. Environ. Rev. 3(1): 29-81.
- NIOSH - NATIONAL INSTITUTE FOR OCCUPATIONAL SAFETY AND HEALTH (2011): Occupational exposure to titanium dioxide. Publication No. 2011-160, US Department of Health and Human Services, Public Health Service, Centers for Disease Control, National Institute of Occupational Safety and Health, Cincinnati, Ohio, USA.
- PRIEST ND (1993): Satellite symposium on Alzheimer's disease and dietary aluminium. Proc Nutr Soc. 52: 231-240.
- PRIEST ND. (2004): The biological behaviour and bioavailability of aluminium in man, with special reference to studies employing aluminium-26 as a tracer: review and study update. J. Environ. Monit. 6: 375-403.
- PULEO DA, HUH WW. (1995): Acute toxicity of metal ions in cultures of osteogenic cells derived from bone marrow stromal cells. J Appl Biomater 6: 109-116.
- REICHL FX (Hrsg.) (2000): Taschenatlas der Umweltmedizin. Georg Thieme Verlag, Stuttgart.
- REICHL FX (Hrsg.) (2002) : Taschenatlas der Toxikologie. 2. akt. Aufl.. Georg Thieme Verlag, Stuttgart.
- RKI – ROBERT KOCH-INSTITUT (2007): Amalgam: Stellungnahme aus umweltmedizinischer Sicht. Mitteilung der Kommission „Methoden und Qualitätssicherung in der Umweltmedizin“. Bundesgesundheitsbl-Gesundheitsforsch-Gesundheitsschutz 50: 1304-1307.
- SCHUBERT J, RILEY EJ, TYLER SA. (1978): Combined effects in toxicology--a rapid systematic testing procedure: cadmium, mercury, and lead. J Toxicol Environ Health. 4(5-6): 763-776.
- SMITH KL, LAWRENCE DA. (1998): Immunomodulation of in vitro antigen presentation by cations. Toxicol Appl Pharmacol. 96(3): 476-484.
- STRIETZEL R, HOSCH A, KALBFLEISCH H et al. (1998): In vitro corrosion of titanium. Biomaterials. 19(16): 1495-1499.
- TOMLJENOVIC L. (2011): Aluminium and Alzheimer's disease: after a century of controversy, is there a plausible link? J Alzheimers Dis. 23(4): 567-598.
- TRAISNEL M, LE MAGUER D, HILDEBRAND HF, IOST A. (1990): Corrosion of surgical implants. Clin Mater. 5(2-4): 309-318.
- UBA – UMWELTBUNDESAMT (1999): Einsatz von Chelatbildnern in der Umweltmedizin? Stellungnahme der Kommission "Human-Biomonitoring" des Umweltbundesamtes. Bundesgesundheitsbl–Gesundheitsforsch–Gesundheitsschutz 42(19): 823-824.
- WAGNER M, KLEIN CL, VAN KOOTEN TG, KIRKPATRICK CJ. (1998): Mechanisms of cell activation by heavy metal ions. J Biomed Mater Res 42: 443-452.
- WANG X, GARRICK MD, YANG F et al. (2005): TNF, IFN-gamma, and endotoxin increase expression of DMT1 in bronchial epithelial cells. Am J Physiol Lung Cell Mol Physiol. 289(1): L24-33.
- WARNER GL, LAWRENCE DA. (1998): The effect of metals on IL-2-related lymphocyte proliferation.Int J Immunopharmacol. 10(5): 629-637.
- WATAHA JC, HANKS CT, SUN Z. (1994): Effect of cell line on in vitro metal ion cytotoxicity. Dent Mater 10: 156-161.
- WITSCHI H. (1999): Some Notes on the History of Haber's Law. Toxicol Sci. 50(2):164-168.
- ZHENG D, WANG N, WANG X, et al. (2012): Effects of the interaction of TiO2 nanoparticles with bisphenol A on their physicochemical properties and in vitro toxicity. J Hazard Mater. 199-200: 426-432.
Autor
Peter Jennrich
Marienstraße 1
97070 Würzburg
Tel.: 0931 329 22 07