Labordiagnostik von Metallbelastungen und individuellen Zahnersatzmaterial- Unverträglichkeiten
Dr. med. Volker von Baehr und Dr. rer. nat. Katrin Huesker
Zu den chronisch entzündlichen Erkrankungen gehören Allergien, Autoimmunerkrankungen und chronische Infektionen. Ihre Inzidenz nimmt in Ländern mit „westlichem Lebensstil“ dramatisch zu. Gemeinsam haben die genannten Erkrankungen, dass bei den betroffenen Patienten das Immunsystem seine Fähigkeit zur Toleranz verliert und sich gegen mehr oder weniger harmlose Reizfaktoren richtet. Die Labordiagnostik wird mit dem Ziel durchgeführt, den Einfluss einer Entzündungsquelle auf den systemischen Entzündungsprozess zu belegen (bzw. auszuschließen) und die bei dem jeweiligen Patienten individuell verantwortlichen Triggerfaktoren zu identifizieren. Nur so ist gerade im Bereich der Zahnmedizin (oralen Medizin) eine gezielte und kausale Therapie möglich. Im Bereich der Zahnmedizin geht es dabei um den Nachweis toxischer Belastungen (z.B. Metallanalysen im Speichel) sowie um das Auffinden individueller immunologischer Unverträglichkeiten gegenüber Zahnersatzmaterialien (Allergien, Titanempfindlichkeit). Desweiteren gibt es inzwischen validierte Laboranalysen, die nachweisen können, in wieweit wurzelgefüllte (tote) Zähne einen Fokus für eine systemische Entzündung darstellen. Die Labordiagnostik im Rahmen der Parodontalerkrankungen umfasst heute nicht mehr nur die Keimdiagnostik, sondern auch den Nachweis individueller immunologischer Reaktionstypen zur optimalen Planung adjuvater Therapiemaßnahmen. Der Beitrag fasst den aktuellen Stand zur „Labordiagnostik für die Zahnmedizin“ zusammen.
Zu den chronisch entzündlichen Erkrankungen gehören Allergien, Autoimmunerkrankungen und chronische Infektionen. Diese Erkrankungen haben zwei Dinge gemeinsam: Zum einen nimmt ihre Inzidenz in Ländern mit „westlichem Lebensstil“ dramatisch zu. So haben sich zum Beispiel Allergien (SCHLA UD et al. 2008), die Multiple Sklerose (ALONSO et al. 2008) und der Morbus Crohn (JACOBSEN et al. 2006) in den letzten 20 Jahren mehr als verdoppelt, und trotz besserer Prophylaxe hat auch die Prävalenz der Parodontitis zugenommen (SCHIFFNER et al. 2009). Gemeinsam haben die genannten Erkrankungen aber auch, dass bei den betroffenen Patienten das Immunsystem seine Fähigkeit zur Toleranz verliert und sich gegen mehr oder weniger harmlose Reizfaktoren (Umweltfaktoren z.B. kommensale Bakterien, Allergene, Schadstoffe) richtet. Nahezu immer sind mehrere dieser Triggerfaktoren beteiligt. Erst in ihrem Zusammenwirken und auf dem Boden oft bestehender individueller Empfindlichkeiten stellen sie den „Auslöser“ der chronischen Entzündung dar. Die individuellen Empfindlichkeiten können angeboren sein, sind aber häufig Folge gestörter biologischer Regelkreise, die selbst Folge des Einwirkens von „unphysiologischen“ Reizen auf den Organismus sind.
Unser Immunsystem ist keinesfalls eine „Angriffsmaschine“. Es verfügt neben den proentzündlichen Immunzellen und Mediatoren auch über zahlreiche antientzündliche Mitspieler und bremsend wirkende Zytokine. Die regulatorischen T-Lymphozyten und die antientzündlichen Zytokine sind dafür verantwortlich, dass unser Immunsystem im Normalfall nicht-bedrohliche Fremdeinwirkungen tolerieren kann. Den antientzündlichen toleranzerhaltenden Mechanismen ist es z.B. zu verdanken, dass die Anwesenheit von Metallionen oder Acrylatmonomeren im Gewebe im Regelfall nicht mit einer entzündlichen Unverträglichkeitsreaktion einhergeht oder zum Beispiel auch, dass nicht jeder Mensch eine Parodontitis entwickelt, sobald anaerobe Keime die Parodontaltasche besiedeln.
An jeder Entzündung sind zwei Faktoren beteiligt. Es muss ein nicht-physiologischer Reiz (Triggerfaktor) bestehen und dieser muss auf ein Immunsystem treffen, welches ihn nicht tolerieren kann. Eine gestörte Immuntoleranz hat zur Folge, dass das Immunsystem auch auf banale und nicht gefährdende Reize mit einer Entzündungsreaktion antwortet. In der Regel ist jeder Patient zahlreichen dieser Reizfaktoren ausgesetzt. In ihrer Gemeinsamkeit stellen sie den (multikausalen) Schlüssel der chronisch entzündlichen Multisystemerkrankung dar. Die Genetik kann für eine so rasante Zunahme entzündlicher Erkrankungen innerhalb weniger Jahrzehnte nicht verantwortlich sein. Vielmehr sind eine Vielzahl individueller Trigger- und Kofaktoren (häufig als Umweltfaktoren bezeichnet) auf der Grundlage einer individuellen Genetik bedeutsam. In unserer modernen Gesellschaft müssen wir uns immer häufiger und mit immer komplexeren Fremdstoffen und (Umwelt)-Einflüssen auseinandersetzen. Diese stellen einerseits, meist multikausal, den Entzündungsauslöser dar, sind aber andererseits auch dafür verantwortlich, dass unser immunologisches Toleranzsystem mehr und mehr gestört wird.

Neben der zunehmenden Belastung mit Innenraumschadstoffen wie Pestiziden, Herbiziden, Weichmachern, Lösungs- und Flammschutzmitteln in unserer Wohn- und Arbeitsumgebung, zunehmender Antigenvielfalt in unserer Nahrung, Nahrungsergänzungsmitteln und vielen anderen Faktoren werden hier die Einbringung alloplastischer Ersatzmaterialien in den Organismus und andere medizinische Maßnahmen (Medikamente, Impfungen, Hormonersatztherapien usw.) diskutiert (Übersicht siehe Abb. 1).
Die Zahnmedizin ist an dem Zuwachs von potentiellen Fremdund Störfaktoren auf den Organismus ebenfalls beteiligt. Die heute unüberschaubare Vielfalt an Zahnersatzmaterialien, die zunehmende Zahl an Implantationen und Implantatfabrikaten, die Versiegelungen und Fluoridierungen, der nicht zu verhindernde Kontakt zu potentiellen Allergenen in der Kieferorthopädie und der Endodontie – all das ist segensreich für die Erhaltung der natürlichen Zähne und damit der Kaufunktion. Man muss aber auch sehen, dass es sich dabei nahezu immer um Fremdmaterialien handelt, welche über vielfältige und oft nur teilweise verstandene Pathomechanismen individuell zu immunaktivierenden Reizen für das Immunsystem werden.
Werkstoffallergien haben aufgrund der allgemein zunehmenden Sensibilisierungsrate auf Metalle, Kunststoffe (Acrylate und andere Bestandteile) und andere Allergene eine wachsende Bedeutung. Permanent eingebrachte potentielle Kontaktallergene stellen bei bestehender Sensibilisierung einen permanenten Fokus dar. Die wichtigsten Auslöser von Typ-IV-Sensibilisierungen im zahnärztlichen Bereich sind Metalle und Acrylate. Freie Metallionen sowie auch Kunststoffmono- und oligomere wirken dabei als Haptene, d.h. sie verändern körpereigene Eiweiße so, dass diese vom Immunsystem als fremd erkannt werden und dann eine Entzündung auslösen.
Der Epikutantest (ECT) wurde vor mehr als 50 Jahren zum Nachweis einer Kontaktallergie der Haut entwickelt. Für systemische Sensibilisierungen (z.B. Medikamente, aber folgerichtig auch aus Zahnersatz freigesetzte Allergene) ist er nicht validiert. Abgesehen davon sind die „Schwachstellen“ des ECT die subjektive Bewertung beim Ablesen der Testergebnisse, die Abhängigkeit des Resultates von der Hautbeschaffenheit der Testperson und natürlich die Belastung des Patienten mit den oft multipel zu testenden Schadstoffen. Negative ECT-Ergebnisse bei klinisch gesicherter Sensibilisierung (d.h. falsch negative Ergebnisse!) sind häufig (MONERET-VAUTRIN 2004, RIETSCHEL et al. 2001). Rustemeyer publizierte für Nickel eine Sensitivität des Hauttestes von lediglich 54 % (RUSTEMEYER 2004). Die Intra-Assay-Reproduzierbarkeit des ECT (Test zweifach zeitgleich beiderseits der Wirbelsäule auf dem Rücken eines Patienten durchgeführt) liegt bei lediglich 56 bis 92 % (ALE & MAIBACH 2004).
Der Lymphozytentransformationstest (LTT) ist die derzeit einzige validierte und akkreditierte Labormethode zum Nachweis einer zellulären Sensibilisierung. Seit seiner ersten Erwähnung 1960 hat sich der LTT durch verbesserte Zellkultur- und Analyseverfahren sowie Zusatz von rekombinantem Interferon-alpha (VON BAEHR et al. 2001) zu einem reproduzierbaren und hochsensitiven Verfahren entwickelt. Die 2008 aktualisierte Stellungnahme des Robert Koch-Institutes sagt, dass eine positive Reaktion im LTT das Vorhandensein von Allergen-spezifischen T-Lymphozyten (Gedächtniszellen) im Blut ohne Belastung des Patienten nachweisen kann (RKI 2008).
Ein weiterer Vorteil des LTT ist die Möglichkeit, auch native Werkstoffe (z.B. Kunststoffproben, Wurzelfüllmaterialien oder Metallplättchen) als Nativmaterial auszutesten (siehe Beispiel in Abb. 2). Dieses ist wichtig, da die Bestandteile insbesondere von Kunststoffmaterialien oft unzureichend deklariert sind. Im Hauttest werden zwar (leider) ebenfalls Acrylat- oder sogar vergossene Metallplättchen eingesetzt, hier ist die Sinnhaftigkeit aber anzuzweifeln, weil sich bei Materialien mit auch nur annährend akzeptablen Materialeigenschaften in so kurzer Zeit nur durch Auflage auf die Haut gar keine ausreichenden Allergenmengen aus dem Material lösen können. Diese Art der Testung ist strikt
abzulehnen, da sie bei den (üblicherweise) negativen Resultaten eine falsche Sicherheit bietet.
Nicht nur bei Verdacht auf eine toxische Belastung sondern im kurativen Fall auch bei nachgewiesener Sensibilisierung stellt sich oft die Frage, ob das nachgewiesene Allergen aus dem Zahnersatzmaterial des Patienten freigesetzt wird. Hier bietet die Multielementanalyse (MEA) mittels ICP-MS („inductively coupled plasma mass spectrometry“) die Möglichkeit, in einer Speichelprobe zahlreiche Metalle bereits in einem Konzentrationsbereich von 1 ng/ml nachzuweisen (siehe Beispiel in Abb. 3). Zu unterscheiden ist die basale Freisetzung, die in einer einfachen Speichelprobe gemessen wird, von der so genannten „stimulierten“ Freisetzung, die durch mehrminütiges Kaugummikauen angeregt wird. Während der Kautätigkeit werden in der Regel deutlich höhere Mengen an Metallen in den Speichel abgegeben als im Ruhezustand, jedoch bedingt der vermehrte Speichelfluss gleichzeitig eine Verdünnung (GANSS et al. 2000).
Indiziert ist eine Messung der Metallbelastung auch dann, wenn keine individuelle Sensibilisierung vorliegt, aber trotzdem der klinische Verdacht auf eine Unverträglichkeit des eingesetzten Materials besteht. Hier könnten toxische Effekte der freigesetzten und verschluckten Metalle zum Tragen kommen – auch dann, wenn die Konzentrationen mehrerer Metalle noch im subtoxischen Bereich liegen, weil Vielfachbelastungen die Wirkungen des einzelnen Metalls potenzieren können (HU et al. 2013). Daher kommen gerade auch bei dieser Fragestellung die Vorteile der hoch sensitiven Multielementanalyse zum Tragen.

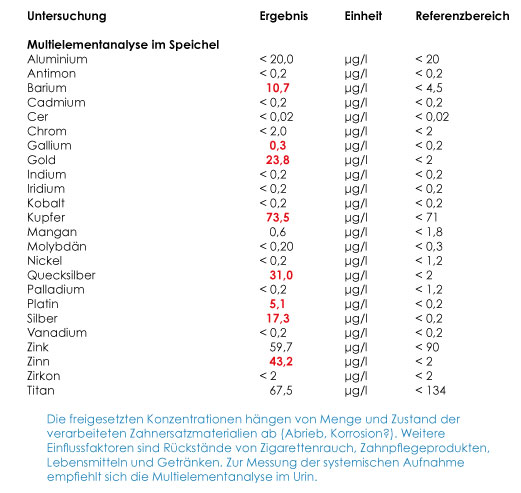
Entscheidenden Einfluss auf die Interpretation einer Multielementanalyse hat die Wahl des Analysematerials. So gibt die Metallbestimmung im Speichel (basal oder stimuliert) vor allem Auskunft über die aktuelle Freisetzung aus dem Zahnersatz. Etwaige Rückstände aus Nahrungsmitteln und Zahncreme fließen jedoch in das Messergebnis ein. Daher sollte vor Speichelentnahme der Mund mehrmals gründlich mit Wasser ausgespült werden und die letzte Mahlzeit und Zahnpflege mindestens zwei Stunden zurückliegen (ELSHAHAWY et al. 2013).
Von der Exposition im Mundraum strikt zu unterscheiden ist die systemische Belastung des Organismus, da der Darm nur einen Teil der Metalle aus dem verschluckten Speichel resorbiert (EKSTRAND et al. 1998). Ferner stammt die systemische Belastung neben dem Zahnersatz aus zahlreichen weiteren Quellen, wie z.B. aus der Nahrung, dem Trinkwasser, der Atemluft sowie möglichen endogenen Quellen (z.B. Endoprothesen). Dennoch zeigen Studien, dass z.B. die Quecksilberkonzentration im Urin mit der Zahl vorhandener Amalgamfüllungen korreliert, entsprechend einer stetigen systemischen Aufnahme aus einer chronischen Expositionsquelle (PESCH et al. 2002). Dies spricht dafür, dass sich die Multielementanalyse im Urin zur Messung der systemischen Metallbelastung aus Zahnersatz eignet – mit der Einschränkung, dass die Messwerte durch akute Belastungen aus anderen Quellen steigen, wie z.B. durch eine Mahlzeit mit belastetem Fisch. Vor allem bei chronischer Belastung wird der basalen Urinmessung oft die Multielementanalyse im Urin nach Gabe von Chelatbildnern (z.B. DMPS, DMSA, EDTA) vorgezogen. Diese binden im Gewebe gespeicherte Schwermetalle und führen sie der renalen Ausscheidung zu (JENNRICH 2007). Eine nachfolgende Multielementanalyse des 24h-Sammelurins gibt Auskunft über die kumulative Gesamtbelastung des Organismus. Die Ausleitung wird damit gleichzeitig diagnostisch und – durch Minderung der Schwermetalllast des Patienten – kurativ genutzt.
Während die äußerst seltenen IgE-vermittelten Typ I-Sensibilisierungen oder Pseudoallergien auf Metalle in der Praxis vernachlässigbar sind, muss bei Acrylaten (z.B. MMA, HEMA, TEGDMA, BIS-GMA) und Naturstoffen (z.B. Guttapercha) auch an Typ-ISensibilisierungen gedacht werden. Vor allem wenn Beschwerden innerhalb weniger Stunden nach Einbringung der Materialien auftreten, sollte dies mit dem Basophilen-Degranulationstest (BDT) untersucht werden.
Der kausale Zusammenhang einer nachgewiesenen Sensibilisierung mit der bestehenden Klinik ist allein durch den LTT oder auch den ECT nicht zu beweisen. Eine Sensibilisierung kann auch latent vorliegen, das heißt, nicht jeder auf ein bestimmtes Allergen sensibilisierte Patient hat zu diesem Zeitpunkt auch eine klinisch manifeste Allergie. Hier kann die Effektorzelltypisierung (auch als „Immuntoleranztest ITT“ bekannt) eine Zusatzaussage liefern, da mit steigendem Anteil an IFN-γ-sezernierenden zirkulierenden TH1-Effektorzellen eine aktuelle zytotoxische Effektorreaktion wahrscheinlicher wird. Allerdings sollte eine unauffällige Effektorzelltypisierung nicht als unbedenklich bewertet werden, weil auch IL-10 auf die Immunbalance störende Effekte vermittelt. Da bei einer Effektorzelltypisierung im Gegensatz zum LTT niemals alle Allergen-spezifischen T-Zellen erfasst werden können, sollte zumindest für die präventive Testung der LTT aufgrund seiner höheren Sensitivität immer vorgezogen werden. Selbst durch parallele Analyse von IL-2 oder TNF-α ist es nicht möglich, jede Art der Sensibilisierung zu erfassen, da es Gedächtniszellen gibt, die keine Zytokine produzieren.
Im Unterschied zu anderen Metallen spielen die Typ IV-Allergien beim Titan kaum eine Rolle. Titan kommt im Gegensatz zu Metallen wie Palladium, Quecksilber oder Nickel im Körper nicht in ionisierter Form vor, da es in physiologischen ph-Wert-Bereichen unmittelbar nach seiner Freisetzung oxidiert. Daher kann Titan nicht wie andere Metalle mit körpereigenen Proteinen reagieren und diese modifizieren. Titan ist deshalb aber nicht „inert“. Titanoxidpartikel rufen eine partikelinduzierte Entzündung hervor, indem sie im Implantat-nahen Gewebe von Makrophagen phagozytiert werden, die diesen Reiz mit der Ausschüttung von osteoresorptiven, proentzündlichen Zytokinen (TNF-α, IL1β) beantworten (STERNER et al. 2004). Da die Hyperreaktivität der Makrophagen weder mit dem Epikutantest noch mit dem Lymphozytentransformationstest nachweisbar ist, wurde für diese Fragestellung mit dem Titan-Stimulationstest ein kostengünstiger Screeningtest entwickelt (DÖRNER et al. 2006). In dem zweiten zur Verfügung stehenden Verfahren werden funktionell relevante Polymorphismen in den Genen für TNF-α, IL1-α, IL1-β und dem IL1-Rezeptorantagonist nachgewiesen. Dieses molekulargenetische Verfahren hat den Vorteil, dass es nicht von aktuellen Entzündungsgeschehen oder immunsuppressiven Therapien beeinflusst wird. Die genetische Testung erlaubt an Hand der gefundenen Allelkombination die Zuordnung zu einem Entzündungsgrad. Patienten mit Entzündungsgrad 2-4 gelten als High-Responder (siehe Beispiel in Abb. 4). Eine Studie bestätigte die prognostische Aussagekraft beider Analysen (JACOBI-GRESSER et al. 2012): Ein positiver Titanstimulationstest stellt nachweislich einen von Alter, Geschlecht und Raucherstatus unabhängigen Risikofaktor dar und erhöht das Risiko für ein Titan-assoziiertes Entzündungsgeschehen bzw. einen Implantatverlust um das 12fache. Dieses Risiko nimmt auch unabhängig vom Ergebnis des Titanstimulationstests mit steigendem Entzündungsgrad signifikant zu. In der Praxis werden beide Teste meist kombiniert eingesetzt.


Im Unterschied zu früher wird die Parodontitis heute nicht mehr als ein ausschließlich infektiologisches (Plaquehypothese) sondern vielmehr als ein immunologisches Geschehen betrachtet. Parodontopathogene Markerkeime stellen zwar einen wichtigen Trigger dar, das eigentliche Problem ist bei progredient verlaufenden Parodontitiden aber eine übergesteigerte Entzündungsantwort auf die Erreger.
In mehr als 85 % der Fälle sind chronische bzw. aggressive Verlaufsformen der Parodontitis durch übersteigerte Reaktionen des parodontalen Entzündungssystems auf das mikrobielle Keimspektrum bedingt (sogenannte „Highresponder“). Die Bestimmung der parodontopathogenen Markerkeime aus der Zahntasche ist gut etabliert. Durch Einsatz der PCR-Chip-Technologie sind heute die 11 am höchsten pathogenen Erreger kostengünstig und reproduzierbar nachweisbar. Der Nachweis des Highresponderstatus erfolgt über die Bestimmung der bereits bei der Titanunverträglichkeit erläuterten genetischen Entzündungsneigung (siehe Beispiel in Abb. 5). Bei Trägern des Grades 2 bis 4 liegt eine signifikant erhöhte Entzündungsneigung und somit nachweislich ein erhöhtes Risiko für chronische und aggressive Verlaufsformen der Parodontitis vor (KORNMAN et al. 1997). Da nur bei diesen Patienten eine begleitende antientzündliche Behandlung indiziert ist, sollte diese Bestimmung des Entzündungsgrades spätestens dann erfolgen, wenn zusätzlich zur Standardtherapie immunmodulierend ko-therapiert werden soll. Dazu zählen auch ätherische Öle oder z.B. die systemische Gabe von NFκB-Hemmern wie Boswellia oder Curcumin. „Lowresponder“ (Grad 0-1) profitieren dagegen eher von einer Immunstimulation (Probiotika, Autovaccine).
Bei ca. 10 % der Patienten mit chronischer Parodontitis liegt nicht die typische erhöhte Entzündungsneigung vor. Aus immunologischer Sicht spricht man von atypischen Parodontopathien. Bei diesen Patienten sind meist Defekte der Schleimhautresistenz sowohl für Aphten aber auch für Parodontitis und Perimukositis verantwortlich. Sowohl ein Mangel an Mannose-bindendem Lektin (MBL), an sekretorischem IgA, sowie auch ein funktioneller Defekt der Granulozyten (Phagozytosedefekt) können für chronische lokale Entzündungen verantwortlich sein (siehe Diagnostik-Schema in Abb. 6). Es versteht sich von selbst, dass bei diesen Patienten antientzündliche Maßnahmen (z.B. auch ätherische Öle) kontraindiziert sind, und hier eher vorübergehend immunstimulierend behandelt werden muss.
Mit aMMP-8 steht erstmals ein Entzündungsmarker zur Verfügung, der unmittelbar in der Zahntasche gemessen werden kann. Mit der Bestimmung dieser aktiven Matrixmetalloproteinase im Sulkusfluid ist eine wesentlich exaktere Stadiendifferenzierung möglich als mit herkömmlichen klinischen Markern. Die aMMP-8-Bestimmung liefert dabei häufig noch vor dem Auftreten von klinischen Anzeichen eine Aussage über den Entzündungsstatus des Parodonts. Erhöhte aMMP8-Werte zeigen eine gesteigerte Kollagenaseaktivität an und können somit lokal wie auch systemisch einen destruktiven Gewebeabbau vorhersagen. Mehrere Studien zeigen, dass Patienten mit erhöhtem aMMP8 in der Zahntasche ein erhöhtes Risiko für die Entwicklung systemischer Komplikationen haben (Diabetes, Frühgeburten, Schlaganfälle).

| UNTERSUCHUNG | MATERIAL | BEMERKUNG |
|---|---|---|
| Sensibilisierungen | ||
| LTT (Lymphozytentransformationstest) | Heparin-Blut und Serum | |
| BDT (Basophilen-Degranulationstest) | ||
| Effektorzelltypisierung | Heparin-Blut | |
| Metalltoxikologie | ||
| Multielementanalyse (MEA) | Speichel zum Nachweis der Belastung aus dem Zahnersatz Urin für Untersuchung der systemischen Belastung | Aluminium, Antimon, Arsen, Beryllium, Blei, Barium, Bor, Cadmium, Cer, Chrom, Gallium, Gold, Indium, Iridium, Kobalt, Kupfer, Mangan, Molybdän, Nickel, Quecksilber, Palladium, Platin, Rhodium, Ruthenium, Silber, Tantal, Thallium, Titan, Wismut, Zinn, Zirkon |
| Titanunverträglichkeit | ||
| Titanstimulationstest | Heparin-Blut | |
| Genetischer Entzündungsgrad | EDTA-Blut, alternativ ein Mundschleimhautabstrich | untersuchte Polymorphismen: IL1A -889 C/T IL1B +3953 C/T IL1RN+2018 T/C TNFα -308 G/A |
| Parodontitis | ||
| Nachweis parodontopathogener Markerkeime (11) | PCR-Abstrich (Papierspitzen) | A. actinomycetemcomitans, P. gingivalis, T. forsythia, T. denticola, P. intermedia, P. micra, F. spec, C. rectus / showae, E.nodatum, E. corrodens, C. gingivalis / ochracea speziellen Papierstreifen zur Abnahme erhalten Sie kostenfrei im Labor |
| Genetischer Entzündungsgrad | s.o. | |
| Genetische Entzündungsmodulation | EDTA-Blut, alternativ ein Mundschleimhautabstrich | untersuchte Polymorphismen: IL-6 -174 C/G IL-10 -592 C/A |
| aMMP8-Bestimmung | GCF / PISF (Papierstreifen) | spezielle Papierstreifen zur Abnahme erhalten Sie kostenfrei im Labor |
| IgA gesamt | Serum | |
| MBL-Spiegel | Serum | |
| Endodontie | ||
| Effektorzelltypisierung auf Mercaptane und Thioethe | Heparin-Blut | |
Tab. 1: Darstellung der für die Zahnmedizin validierte und empfohlene Laboranalysen.
Selbst mit noch so perfekten Methoden der Wurzelkanalbehandlung ist es unmöglich, zerfallenes Gewebe vollständig aus einem Zahn zu entfernen. Somit entstehen potentiell immunogene Stoffe wie Mercaptane und Thioether. Die Toxizität dieser Produkte ist unbestritten, wobei die toxischen Effekte allein nicht die beschriebenen Entzündungsreaktionen erklären können. Diesen liegen immunologische Reaktionen zugrunde. Die Diagnostik erfolgt mit der Effektorzelltypisierung auf Mercaptane und Thioether. Jedes positive Ergebnis zeigt an, dass diese Substanzen für das Immunsystem eine Belastung darstellen. Der Grad der Belastung ergibt sich dabei aus der Höhe der Immunreaktion und aus dem Verhältnis von induziertem IFN-α im Vergleich zum Balance-induzierenden IL-10.
Bei den von wurzelbehandelten Zähnen ausgehenden Entzündungsprozessen sollten allerdings auch immer Sensibilisierungen auf die verwendeten Wurzelfüllmaterialien mit dem LTT und/oder BDT ausgeschlossen werden.
Der gezielte Einsatz verschiedener Laborverfahren (Zusammenstellung siehe Tab. 1) auf der Basis einer ausführlichen Anamnese und klinischen Untersuchung sowie die Interpretation der Ergebnisse erfordert einen engen Dialog zwischen Zahnarzt, Arzt und allen beteiligten Ko-Therapeuten. Zukünftig sollte die intensive interdisziplinäre Kommunikation zwischen Zahnmedizin und kurativer Umweltmedizin Grundlage für eine optimale Behandlung betroffener Patienten sein.
- ALE SI, MAIBACH HI. (2004): Reproducibility of patch test results : a concurrent right-versus left study using TRUE Test. Contct Dermatitis 50(5): 304-312.
- ALONSO A, HERNÁN MA. (2008): Temporal trends in the incidence of multiple sclerosis: a systematic review. Neurology 71: 129-135.
- DÖRNER, T, HAAS, J, LODDENKEMPER, C et al. (2006): Implant-related inflammatory arthritis. Nat Clin Pract Rheumatol 2(1): 53-56.
- EKSTRAND J, BJÖRKMAN L, EDLUND C, SANDBORGH-ENGLUND G. (1998): Toxicological aspects on the release and systemic uptake of mercury from dental amalgam.
- Eur J Oral Sci. 106(2 Pt 2): 678-686.
- ELSHAHAWY W, AJLOUNI R, JAMES W et al. (2013): Elemental ion release from fixed restorative materials into patient saliva. J Oral Rehabil. 40: 381-388.
- GANSS C, GOTTWALD B, TRAENCKNER I et al. (2000): Relation between mercury concentrations in saliva, blood and urine in subjects with amalgam restorations. Clin Oral Invest. 4: 206-211.
- HU L, GREER J, SOLO-GABRIELE H et al. (2013): Arsenic toxicity in the human nerve cell line SK-N-SH in the presence of chromium and copper. Chemosphere 91:1082-1087.
- JACOBI-GRESSER E, HUESKER K, SCHÜTT S. (2012): Genetic and immunological markers predict titanium implant failure: a retrospective study. Int J Oral Miaxillofac Surg. dx.doi.org 10.1016/ j.ijom. 2012.07.018, [http://www.europaem.de/chemical/metall/Jacobi_Gresser_titanium_2012.pdf, letzter Zugriff: 8.10.2013]; Kurzfassung: JACOBI-GRESSER E. (2013): Prognose der Einheilquote von Titanimplantaten anhand von Laborparametern - eine retrospektive Studie. umwelt-med-gesellschaft 26(2): 98-103.
- JACOBSEN BA, FALLINGBORG J, RASMUSSEN HH et al. (2006): Increase in incidence and prevalence of inflammatory bowel disease in northern Denmark: a population-based study, 1978-2002. Eur J Gastroenterol Hepatol. 18: 601-606.
- JENNRICH P. (2007): Schwermetalle. Ursache für Zivilisationskrankheiten. CO’MED Verlagsgesellschaft mbH. Hochheim.
- KORNMAN KS, CRANE A, WANG HY et al. (1997): The interleukin-1 genotype as a severity factor in adult periodontal disease. J Clin Periodontol. 1: 72-77.
- MONERET-VAUTRIN DA. (2004): Allergy to nickel in dental alloys. Europ Annals of Allergy and Clin Immunol. 36: 311-312.
- PESCH A, WILHELM M, ROSTEK U et al. (2002): Mercury concentrations in urine, scalp hair and saliva in children from Germany. J Expo Anal Environ Epidemiol. 12: 252-258.
- RIETSCHEL RL et al. (2001): Practical aspects of patch testing, in: RIETSCHEL RL, FOWLER JF (Hrsg.) (2001): Fisher´s Contact Dermatitis, 5th edn. Philadelphia: Lippincott Williams & Wilkins: 9-26.
- RKI - ROBERT KOCH-INSTITUT (2008): Qualitätssicherung beim Lymphozytentransformationstest - Addendum zum LTT-Papier der RKI-Kommission "Methoden und Qualitätssicherung in der Umweltmedizin". Bundesgesundheitsbl - Gesundheitsforsch – Gesundheitsschutz 51: 1070–1076 [http://edoc.rki.de/documents/rki_ab/re67flHRghoUo/PDF/26C0oxyqIxZYff.pdf, letzter Zugriff: 8.10.2013].
- RUSTEMEYER T. (2004): Analysis of effector and regulatory immune reactivity to nickel. Clin Exp Allergy 34: 1458-1466.
- SCHIFFNER U, HOFFMANN T, KERSCHBAUM T et al. (2009): Oral health in German children, adolescents, adults and senior citizens in 2005. Community Dent Health. 26: 18-22.
- SCHLAUD M, ATZPODIEN K, THIERFELDER W. (2007): Allergische Erkrankungen – Ergebnisse aus dem Kinder- und Jugendgesundheitssurvey (KiGGS). Bundesgesundheitsbl – Gesundheitsforsch – Gesundheitsschutz 50: 701-710 [http://edoc.rki.de/oa/articles/reRhnrND9xOGA/PDF/27Kp0kRUqJI.pdf; Zugriff: 14.10.2013].
- STERNER T, SCHÜTZE N, SAXLER G. (2004): Effects of clinically relevant alumina ceramic, zirconia ceramic and titanium particles of different sizes and concentrations on TNFα release in a human macrophage cell line. Biomed Tech. 49: 340-4.
- VON BAEHR V, MAYER W, LIEBENTHAL C et al. (2001): Improving the in vitro antigen specific T cell proliferation assay: the use of inter-feron-alpha to elicit antigen specific stimulation and decrease bystander proliferation. J Immunol Methods. 251: 63-71.
Dieser Artikel ist in der UMG 4/2013 erschienen.
Kontakt:
Dr. med. Volker von Baehr
Dr. rer. nat. Katrin Huesker
IMD Institut für Medizinische Diagnostik Berlin-Potsdam GbR
Labor für Spezielle Immunologie
Nicolaistrasse 22, 12247 Berlin
Tel.: 030/ 77001-220
E-Mail: v.baehr@~@imd-berlin.de
E-Mail: k.huesker@~@imd-berlin.de